Introducción
Los ensayos clínicos aleatorizados (ECA) tienen un diseño que permite contar con suficientes observaciones sistematizadas para conocer el efecto de distintos tipos de terapias, intervenciones o fármacos en los seres humanos, antes de prescribirlos de manera rutinaria.
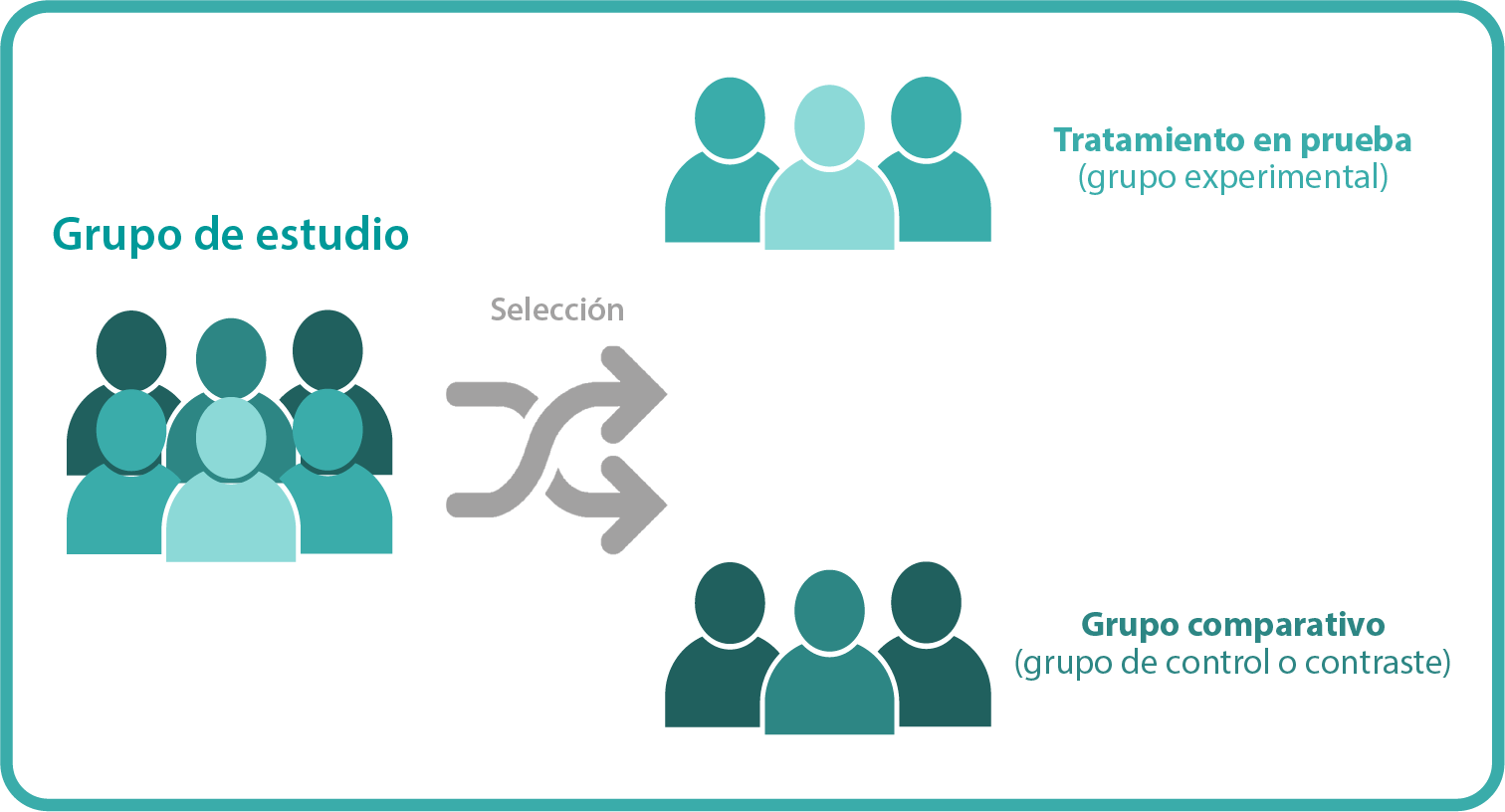
Los ECA son estrategias diseñadas para evaluar la eficacia de un tratamiento en el ser humano mediante la comparación de la frecuencia de un determinado evento de interés clínico —o desenlace— en un grupo de enfermos tratado con la terapia en prueba, con la de otro grupo de enfermos que recibe un tratamiento de control. Ambos grupos de enfermos son reclutados y seguidos de la misma manera y observados durante un mismo periodo de tiempo.
La esencia de los ensayos clínicos es que el propio investigador decide qué individuos serán sometidos al tratamiento en prueba —grupo experimental— y quiénes estarán en el comparativo —grupo de control o contraste—.
 ECA
ECA
Los ECA han permitido el avance de la medicina clínica, al proporcionar una herramienta para poder probar la eficacia y la seguridad de nuevos tratamientos; actualmente, son el estándar de oro o paradigma en la evaluación de la utilidad de nuevos tratamientos.
A pesar de no ser infalibles y de, en ocasiones, resultar cuestionables los estudios experimentales, especialmente desde el punto de vista ético, han contribuido enormemente a la evolución hacia terapias y medidas profilácticas más eficaces y seguras.
En esta UAPA, aprenderás cuáles son sus principales características, los tipos de diseños que existen, así como su utilidad e importancia.
Objetivo
Identificar las principales características de los ensayos clínicos aleatorizados, considerando los distintos tipos de diseño que existen, sus características, ventajas y desventajas, con la finalidad de reconocer su utilidad y aplicar este diseño en la práctica/investigación clínica.
Generalidades de los ECA
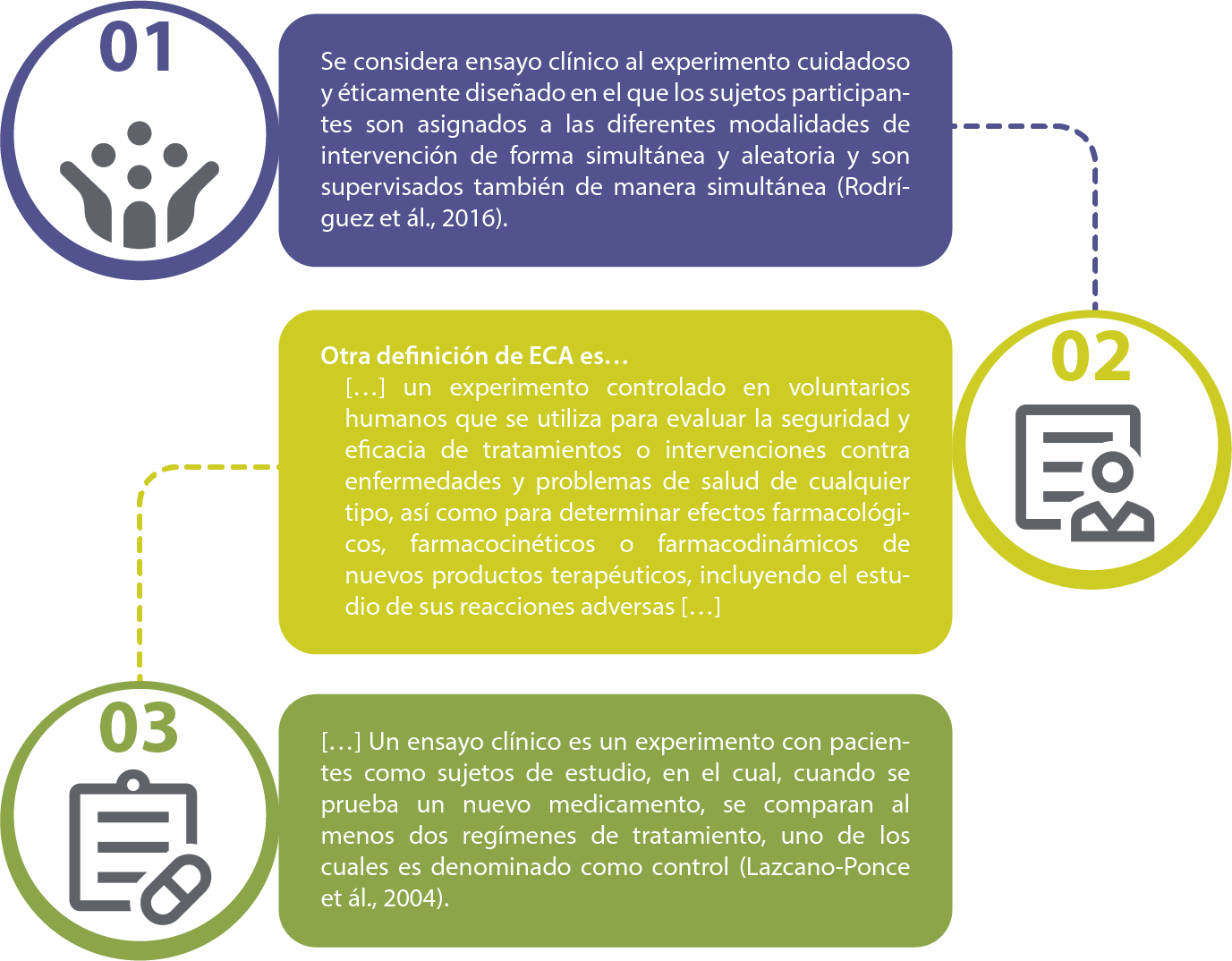
Para iniciar, es importante que comencemos por definir qué son los ECA:
 Definiciones de ECA
Definiciones de ECA
El ECA es actualmente un paradigma en la investigación médica, porque son los diseños que más se acercan a un experimento, por el control de las condiciones bajo estudio y porque pueden establecer relaciones de causa-efecto. Hoy, se considera que esta metodología es el estándar para la investigación clínica cuando se comparan dos o más alternativas terapéuticas en condiciones de incertidumbre y se acepta ampliamente como la manera óptima de minimizar los diversos sesgos que se pueden presentar en estudios de esta naturaleza; es el camino óptimo para resolver un problema en investigación clínica.
Reseña histórica
Este tipo de diseño ha revolucionado la práctica médica alrededor del mundo. Por siglos, los médicos se han enfrentado a los mismos dilemas: cómo comparar diferentes intervenciones terapéuticas y cómo evitar la posibilidad de sesgos al realizarlas. Es momento de revisar el transcurso histórico con las fechas más relevantes en torno a la evolución de los ECA:
Como pudiste ver, los ECA han evolucionado a lo largo de la historia; actualmente, podemos decir que se consideran como el paradigma de la investigación epidemiológica, pues son los estudios que más se acercan a un experimento, ya que se controlan cuidadosamente las variables en estudio y esto permite establecer relaciones de causa-efecto. La aleatorización de los sujetos incluidos en los estudios, así como el blindaje o el cegamiento, son fundamentales para la reducción de sesgos (Demirdjian, 2006).
Por otra parte, la utilización de placebo en estudios donde se incluyen pacientes con enfermedades potencialmente mortales, como diferentes tipos de cáncer, han generado gran cantidad de discusiones de tipo ético.
Finalmente, un gran volumen de estos estudios se desarrolla en el marco de grandes empresas farmacéuticas, donde las ganancias económicas siguen siendo un motivo fundamental para el desarrollo de nuevos fármacos; pensemos, por ejemplo, el caso de las vacunas contra el SARS-CoV-2, desarrolladas por la farmacéutica Pfizer, que jugaron un papel fundamental contra la COVID-19, pero también generaron grandes ganancias económicas.
Ahora que ya conoces el desarrollo histórico de los ECA, vamos a analizar dos conceptos básicos en este tipo de diseños: aleatorización y cegamiento.
Aleatorización
La aleatorización se refiere a la probabilidad que tiene cada participante de ser asignado en una u otra intervención; es decir, grupo experimental o de control; en ambos grupos, la probabilidad debe ser la misma.
Con ello, se garantiza que el otorgamiento de la intervención no sea debido a la percepción del participante —por ejemplo, suponer que sirve el fármaco— o de los investigadores —por ejemplo, brindar el fármaco en estudio a los pacientes más graves—. De hecho, desde hace años, la aleatorización es la que se considera la estrategia más importante para determinar si una intervención es eficaz o efectiva.

Freepik. (s. f.). Concepto de redes [fotografía].
Tomada de https://www.freepik.es/foto-gratis/surtido-bodegones-concepto-redes_
16234427.htm#query=aleatorizaci%C3%B3n&position=9
&from_view=search&track=ais
Aleatorización
La aleatorización tiene otra ventaja importante: balancear las posibles variables de confusión entre el grupo experimental y el de control, las cuales pueden modificar los resultados de la investigación. Cuando se logra que la frecuencia y la distribución de las diferentes variables sean similares entre los dos grupos, los resultados del estudio serán más confiables, de tal forma que, si los resultados arrojan que el grupo experimental tuvo mayor beneficio, se puede asumir que dicha intervención es la directamente responsable de modificar el curso de la enfermedad.
La aleatorización simple es la forma más frecuente y puede realizarse de diversas maneras. Revisa todas las opciones en las que se puede llevar a cabo:
Cegamiento
De acuerdo con Zurita-Cruz et ál. (2018):

Sin embargo, aun cuando la variable de desenlace se mida de manera dura, como los resultados de exámenes de laboratorio, lo ideal es que todo ensayo clínico siempre sea cegado. Cuando los participantes del estudio desconocen —es decir, están cegados— la intervención que están recibiendo —por ejemplo, fármaco activo o placebo—, entonces, el efecto real de la intervención será obtenido al momento de hacer la evaluación de los resultados.
El propósito del cegamiento en los investigadores es para evitar una interpretación errónea cuando se realice la evaluación de la(s) variable(s) desenlace en los participantes en el estudio; por ejemplo, es posible que, al conocer a los pacientes del grupo del fármaco activo, se haga mayor número de tomas de la variable de resultado cuando no parece haber efecto terapéutico; o bien, puede ocurrir que, en el grupo de control, se lleven a cabo otras maniobras —conocidas como cointervenciones—, a fin de proteger a los pacientes, si se piensa que deberían recibir otro tratamiento.
● Tipos de cegamiento
Como puede haber combinaciones, existen diversos tipos de estudios: ciego, ciego simple, doble ciego o triple ciego. Si el paciente o el investigador están cegados, será ciego simple, mientras que, cuando ambos están cegados, el estudio se considera doble ciego. En el caso del triple, los resultados del estudio doble ciego no se dan a conocer hasta que el estudio ha terminado.
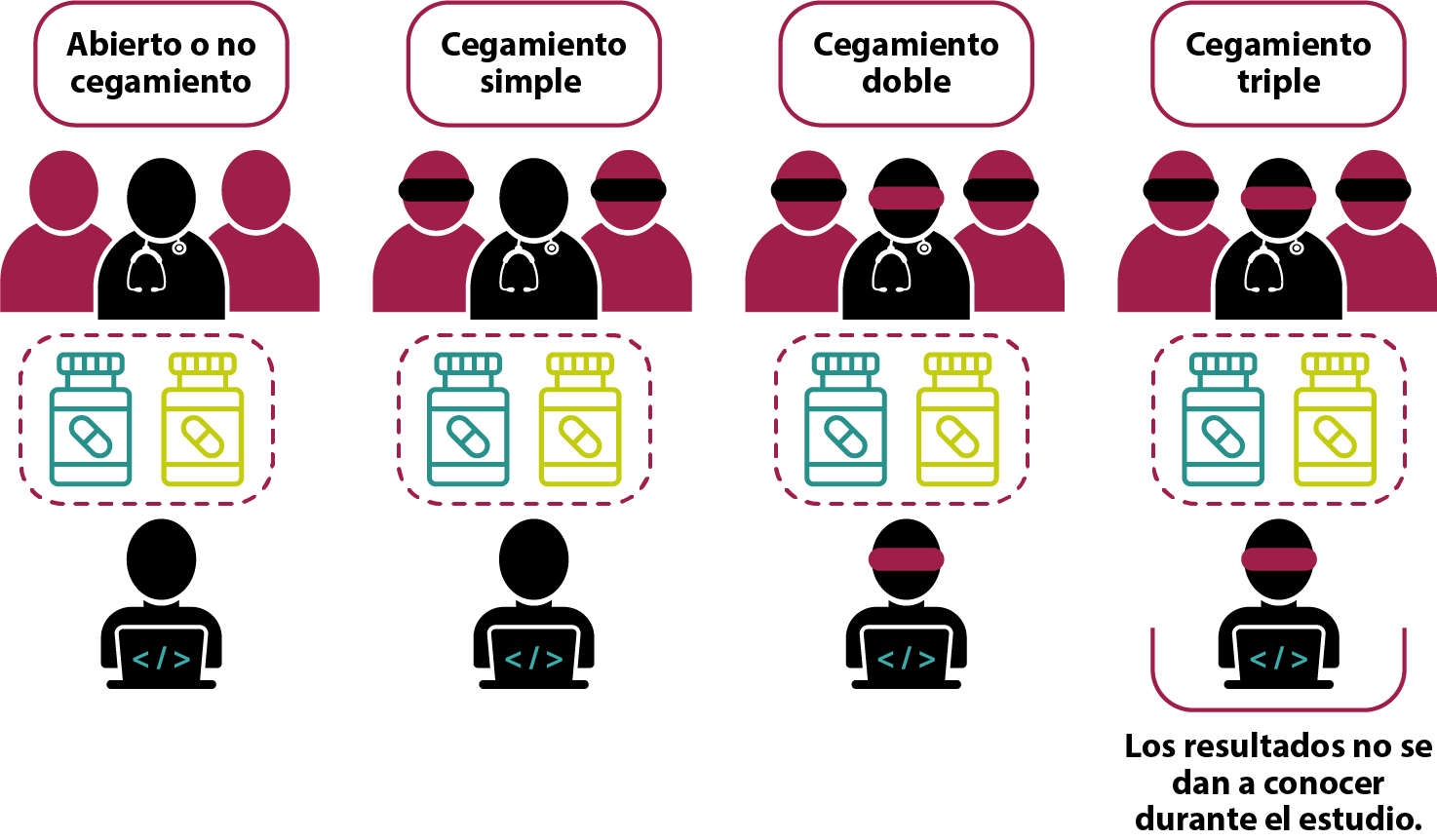
Cuando no se lleva a cabo algún tipo de cegamiento, el diseño de investigación se denomina ECA abierto. En la tabla 1, se pueden observar los diferentes tipos de cegamiento y sus ventajas (Lazcano-Ponce et ál., 2004):
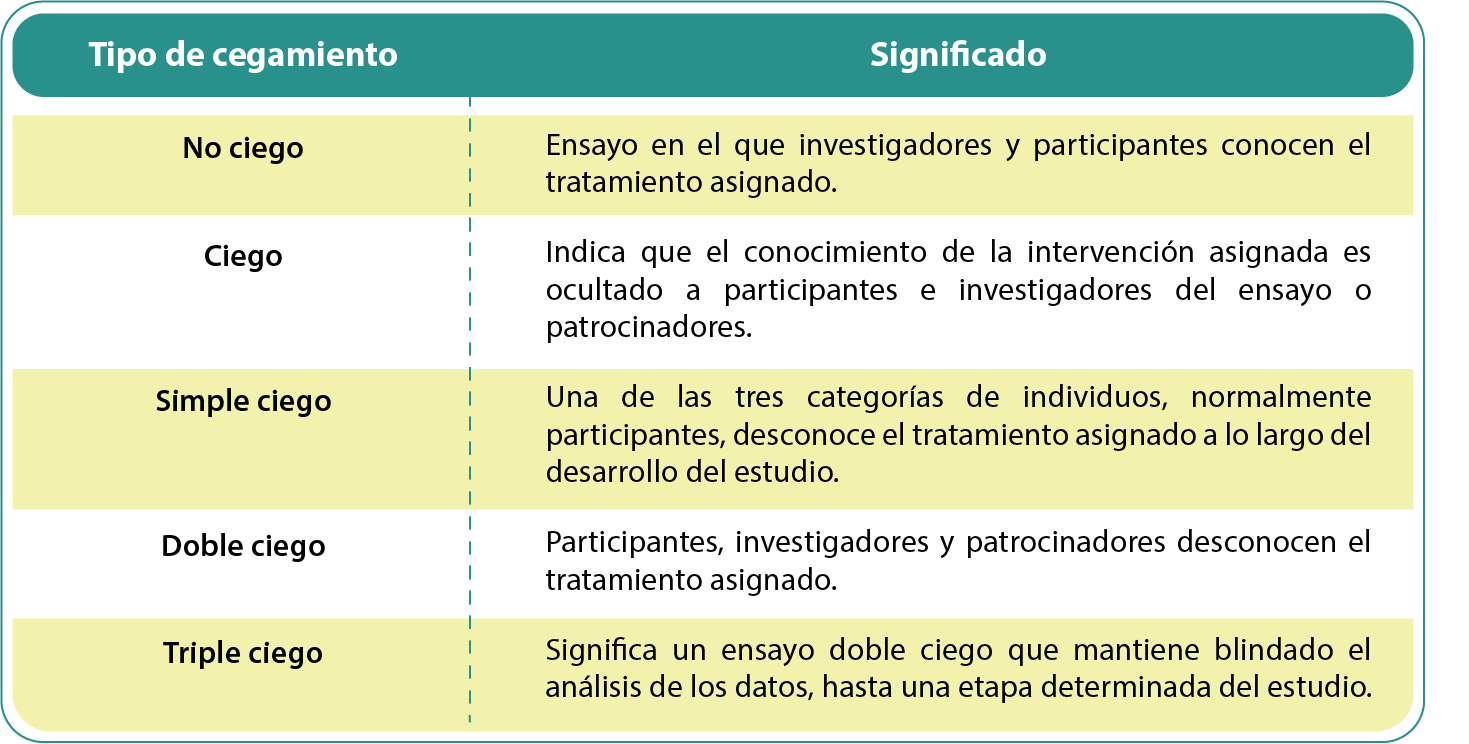 Tabla 1. Tipos de cegamiento y sus características
Tabla 1. Tipos de cegamiento y sus características
Características y utilidad de los ECA
Para iniciar, es importante que conozcas los diferentes tipos de estudio que existen en el campo de la epidemiología clínica —puedes consultar las otras UAPA de la serie Los Clásicos de la Epidemiología—; éstos son:
 Freepik. (s. f.). Investigador de cerca mirando a través de la lente ocular [fotografía]. Tomada de https://bit.ly/3PaZwqN
Freepik. (s. f.). Investigador de cerca mirando a través de la lente ocular [fotografía]. Tomada de https://bit.ly/3PaZwqN
Tipos de estudio de acuerdo con la intervención del investigador
Los ECA son estudios experimentales, ya que, como veremos más adelante, el investigador manipula o asigna la exposición en forma intencional y aleatoria; este tipo de estudios se caracterizan por lo siguiente:
Así pues, los ECA son experimentos controlados en voluntarios humanos que se emplean para evaluar la seguridad y la eficacia de tratamientos o intervenciones contra enfermedades y problemas de salud de cualquier tipo, así como para determinar efectos farmacológicos, farmacocinéticos o farmacodinámicos de nuevos productos terapéuticos, incluyendo el estudio de sus reacciones adversas.
Es decir, un ECA es un experimento con pacientes como sujetos de estudio, en el cual, cuando se prueba un nuevo medicamento, se comparan, por lo menos, dos regímenes de tratamiento, uno de los cuales se usa como control
(Lazcano-Ponce et ál., 2021, p. 96).
Los ECA correctamente ejecutados proporcionan la mejor evidencia sobre el efecto de las intervenciones sanitarias, pero una metodología inadecuada puede resultar en estimaciones sesgadas de este efecto, con los consecuentes problemas al sacar conclusiones y tomar decisiones clínicas o sanitarias (Jüni et ál., 2001); sin embargo, existe un alto grado de certeza en cuanto a la comprobación de causa-efecto y entre la exposición y el evento en estudio. En este sentido, en el protocolo de los ECA, deben contemplarse tres aspectos básicos:
Acordeón vertical A
1. Definir
Definir, en forma clara, el objetivo específico del tratamiento como, por ejemplo, mejorar o eliminar los síntomas, curar la enfermedad o, en el caso de las enfermedades terminales, cómo paliarlas.
2. Seleccionar
Se debe seleccionar el tratamiento más específico y adecuado para el problema en estudio, así como el diagnóstico que deberá estar plenamente confirmado.
3. Determinar
Determinar el blanco del tratamiento, saber cuánto tiempo se administrará y qué dosis utilizar; si no se dan los resultados esperados, contar con una segunda alternativa.
Debido a que los ECA son longitudinales y prospectivos, los sesgos a lo largo del estudio se reducen, aunque éstos pueden estar presentes durante la selección y la estratificación de los grupos, en la asignación de la maniobra experimental, así como también durante el seguimiento y el apego al tratamiento. En general, con un diseño y planeación cuidadosos, los sesgos pueden reducirse. Una desventaja de estos estudios es que son complejos, de larga duración y tienen un costo elevado. Su utilidad se muestra en la siguiente tabla:
 Tabla 2. Utilidad de los ECA
Tabla 2. Utilidad de los ECA
La principal ventaja de un ensayo clínico es su capacidad de demostrar causalidad; la aleatorización disminuye la probabilidad de variables confusoras y el cegamiento reduce el riesgo de que los efectos se deban a una cointervención o a una evaluación sesgada. Como podrás ver, múltiples son las utilidades que los ECA tienen en el campo de la epidemiología clínica y de la clínica; a continuación, revisaremos su clasificación.
Clasificación de los ECA
Los ECA pueden clasificarse de acuerdo con la estructura del tratamiento, ya que pueden ser agrupados en paralelo, donde los grupos incluidos en un tratamiento asignado al azar lo continúan durante el tiempo que dura el estudio. Revisaremos los distintos tipos que existen.
Diseño clásico aleatorizado
Éste es el diseño clásico de este tipo de estudios (Zurita-Cruz et ál., 2018):
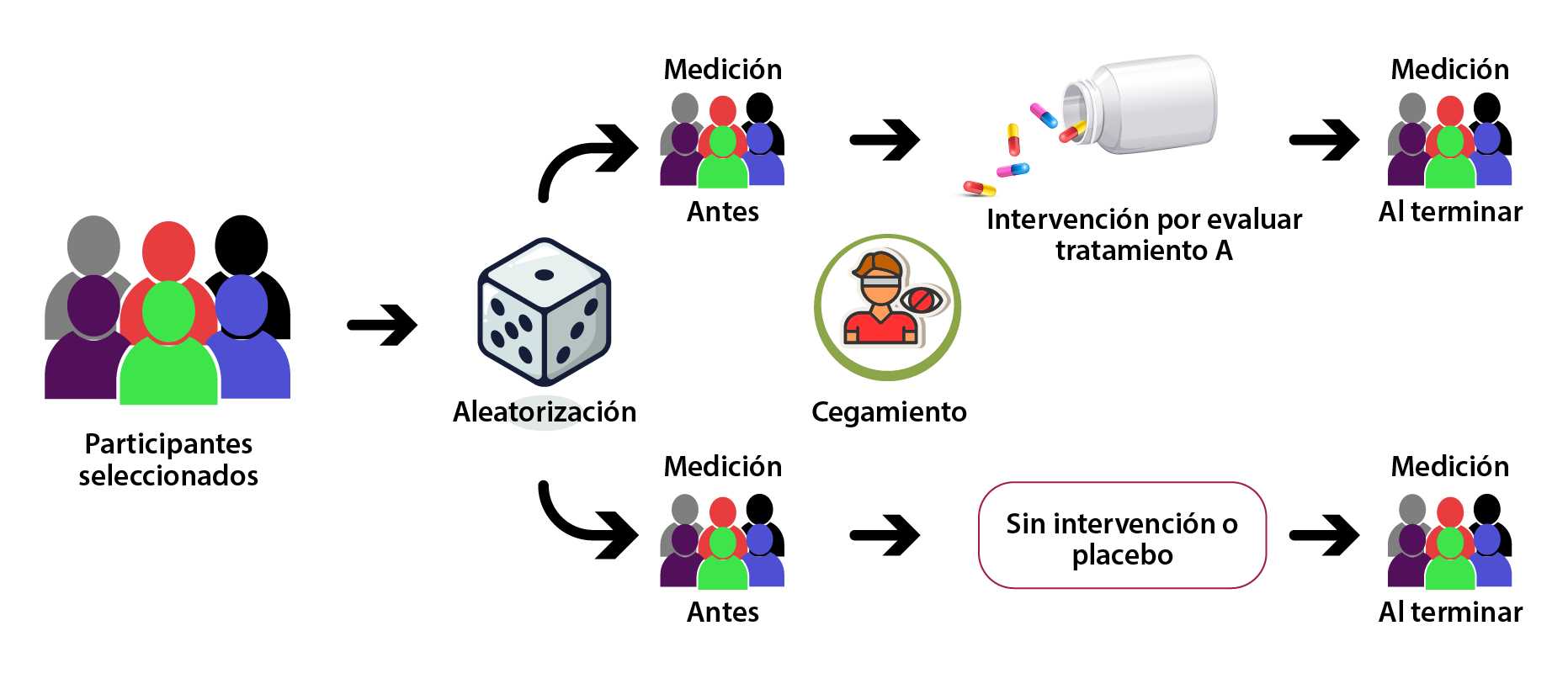 Figura 1. Diseño clásico de ECA
Figura 1. Diseño clásico de ECA
● Características
Este diseño aleatorizado es el más riguroso para la evaluación de cualquier intervención; debe cumplir con cuatro características principales:
- Utilizar un grupo de control que permita la comparación del efecto de la intervención sobre los grupos.
- La asignación de la intervención debe ser al azar para evitar que la aplicación de la intervención dependa de los investigadores; además, ayuda a que las características iniciales entre los grupos sean semejantes.
- La medición de la(s) variable(s) de desenlace deben ser cegadas, lo cual evita sesgos de información.
- Al término del estudio, la mayoría (≈90 %) de los participantes deben haber tenido una vigilancia completa durante todo el periodo del estudio.
Además del diseño clásico de ECA que acabamos de revisar, existen otros diseños que son una modificación de éste; a continuación, revisaremos algunos de los más empleados.
Diseño de tratamiento sucesivo
En este ECA, los grupos en estudio son asignados a un tratamiento primero, a otro después; entre ambos, suele dejarse un tiempo sin tratamiento, normalmente siete vidas medias del fármaco que se utilizó, primero para “lavar” todos los rastros de éste en el organismo; con ello, se evitan los efectos secundarios o residuales del primer tratamiento. En el diseño de tratamiento sucesivo, existen, a su vez, dos tipos:
Acordeón vertical 2
Diseño de ensayo clínico de reemplazo
Los grupos reciben inicialmente un tratamiento semejante; en una segunda ocasión, cada grupo recibe un tratamiento diferente (figura 2).

Figura 2. Diseño de ensayo clínico de reemplazo
Diseño de ensayo clínico cruzado
El segundo tipo es el diseño cruzado, en el cual intervienen dos grupos de tratamiento: 1 y 2; el grupo 1 recibe el tratamiento A y, en un segundo periodo, el tratamiento B; el grupo 2 recibe los mismos esquemas de tratamiento, pero en sentido inverso al grupo 1.
En estos grupos, por lo general, el mismo paciente es su propio control, y los grupos son pequeños. Este diseño es ideal en pacientes con enfermedades raras o cuando se utilizan tratamientos costosos (figura 3).

Figura 3. Diseño de ensayo clínico cruzado
Intervenciones múltiples
En estos diseños, es importante enfatizar el periodo de “lavado” que debe haber entre cada una de las intervenciones, tal como se muestra en la figura 4, para evitar los efectos residuales del tratamiento anterior. Este periodo, como se mencionó antes, depende de la duración de la vida media del fármaco empleado.
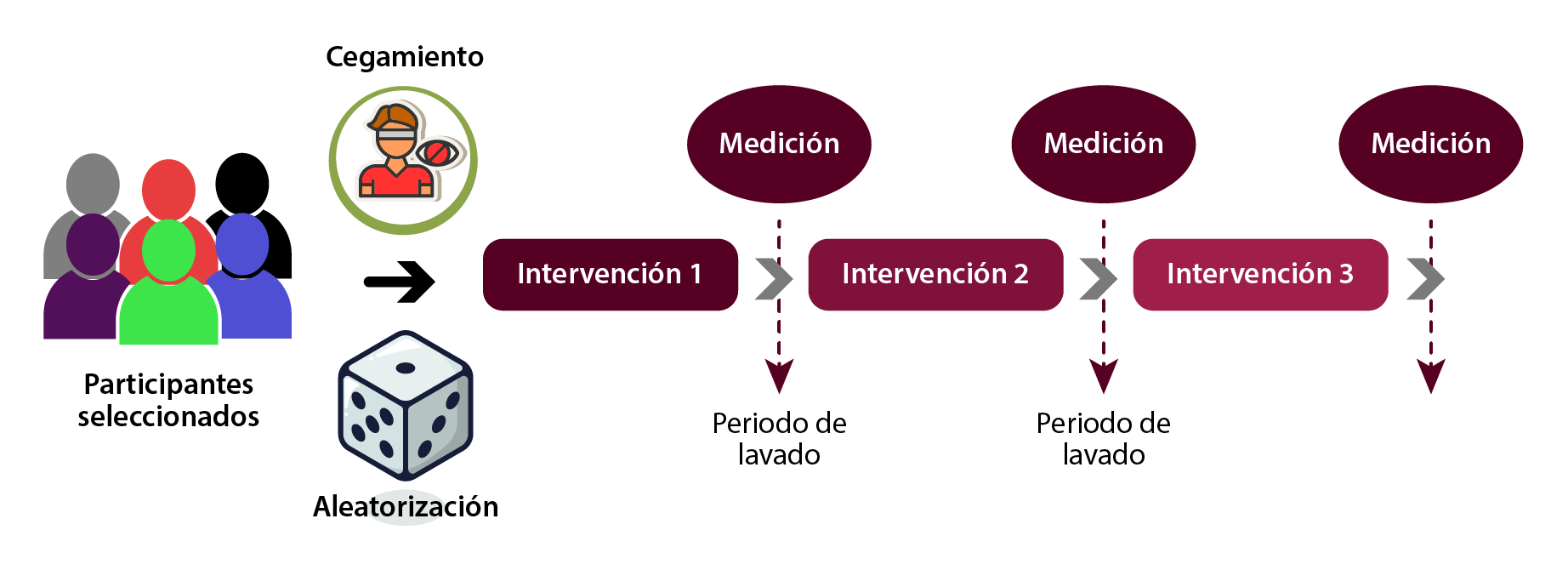
Figura 4. Intervenciones múltiples
Variantes de los ensayos cruzados
Es importante mencionar que una variante de los ensayos cruzados es el “N de 1”. En este tipo de estudios, sólo existe un paciente con una condición crónica, pero con dos o más alternativas terapéuticas, siendo el mismo sujeto su propio control. Como también es un ECA, pero únicamente con un participante, entonces, la aleatorización se dará en el momento de brindar cualquiera de las intervenciones.
Por ejemplo:
Las secuencias de las intervenciones pueden ser 1, 2, 3; 3, 1, 2; o 2, 3, 1.
La desventaja consiste en que puede ocurrir un efecto de aprendizaje del participante en el estudio, además del efecto acumulado tras recibir múltiples medicamentos durante sus etapas (Zurita-Cruz et ál., 2018).
Diseños alternativos
También existen otras variantes: son los diseños alternativos, los cuales, a su vez, se dividen en factoriales, que son ensayos clínicos en los que se evalúan dos o más intervenciones en las que se puede usar un diseño de tipo paralelo; por ejemplo, si se desea probar la eficacia del medicamento A comparándolo con el B, pero tomando en cuenta dos diferentes dosis de cada medicamento —dosis X y Y—, entonces, se requerirá conformar cuatro grupos (figura 5):
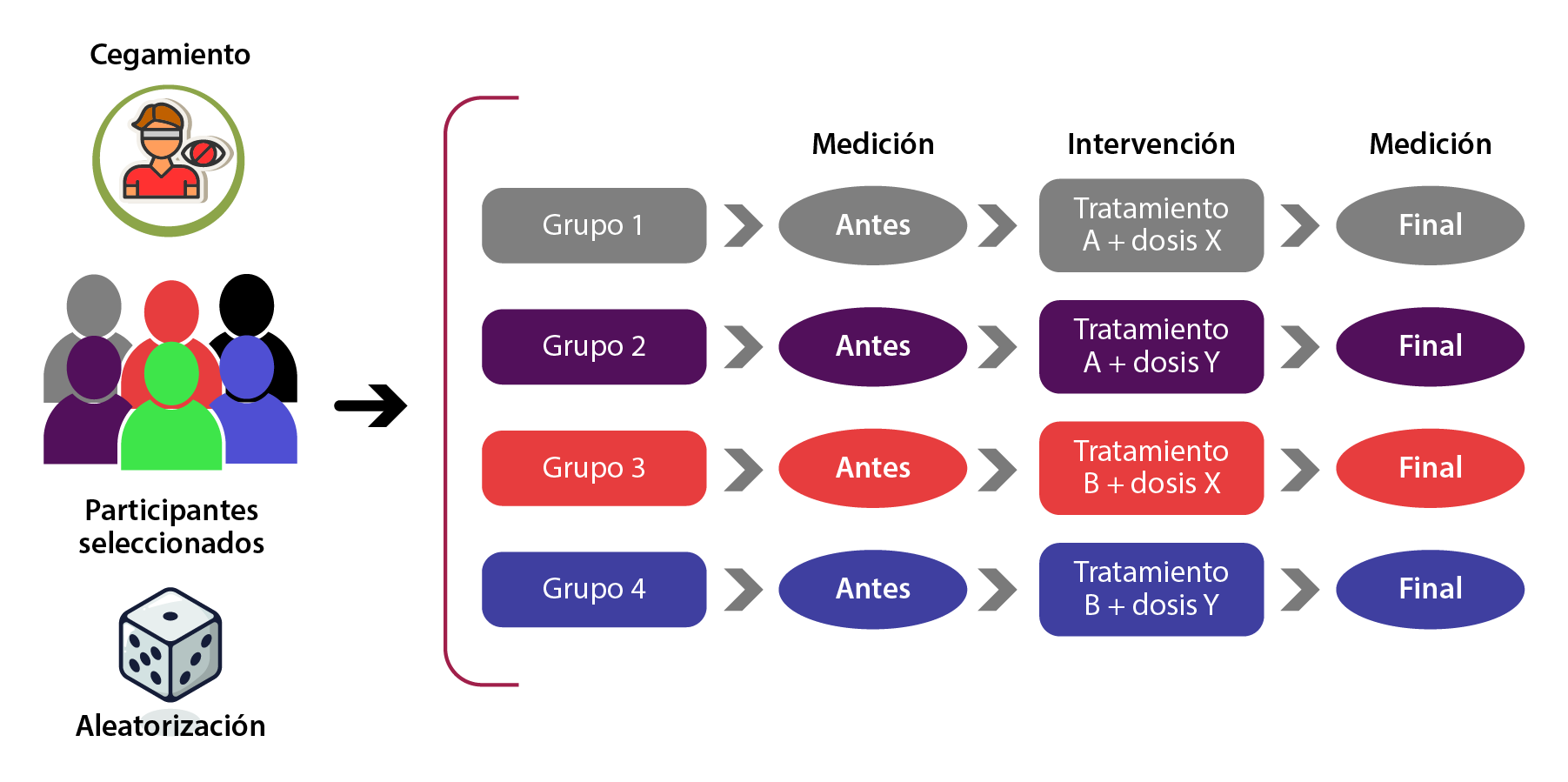 Figura 5. Diseño alternativo
Figura 5. Diseño alternativo
La utilidad de este tipo de diseño es analizar la interacción del efecto de más de dos intervenciones que se incluyen en el estudio.
Otro tipo de diseño alternativo es el de equivalencia que se utilizan para demostrar si dos tratamientos son similares respecto a la respuesta del paciente. Son diseños no sesgados que evalúan diferencias en el tratamiento cercanas a cero y con un estrecho intervalo de confianza (Lazcano-Ponce et al., 2021).
Fases de un ECA para evaluar nuevos medicamentos
La investigación clínica de evaluación de un nuevo agente terapéutico previamente no evaluado, incluidas las vacunas, es generalmente dividida en cuatro fases. Aunque las fases pueden ser conducidas secuencialmente, en algunas situaciones, se pueden traslapar. De acuerdo con Lazcano-Ponce et ál. (2004), se revisan, a continuación, cada una de ellas:
El objetivo de estos estudios está muy definido: obtener conocimiento adicional de la eficacia y la seguridad de un medicamento.
Medidas de asociación en los ECA
Hemos mencionado con anterioridad que una de las grandes ventajas de los ECA es su capacidad para demostrar causalidad; por esto, es fundamental contar con medidas que nos permitan evaluar las asociaciones que se establecen entre variables de exposición —por ejemplo, un nuevo fármaco— y eventos de interés —por ejemplo, alivio de los síntomas o curación de la enfermedad—. A continuación, estudiaremos una serie de medidas de asociación que permiten estimar la magnitud de la asociación entre las variables, aplicándose al estudio de las relaciones causales (Estrada et ál., 2020; Ranganathan et ál., 2016; Manterola y Otzen, 2015; Molina-Arias, 2012).
Si bien la RAR, la RRR y el NNT otorgan información sobre la magnitud del efecto del tratamiento, están fuertemente relacionados a la variabilidad del parámetro medido y al tamaño de la muestra. Por ello, deben reportarse junto a intervalos de confianza que entreguen información sobre la precisión de los hallazgos.
Conclusión
La investigación clínica, a través de este tipo de diseño, genera conocimiento que sirve para mejorar la salud y el bienestar o aumentar la comprensión de la biología humana. Los ensayos clínicos, como un paradigma de la investigación clínica, proporcionan innumerables beneficios para una asistencia médica de calidad, producen cambios en indicadores de salud y garantizan mejores estándares de diagnóstico, evaluación y tratamiento de enfermedades.
Muchos productos evaluados con ECA ofrecen una alternativa de vida y salud en diversos campos, con una repercusión social importante; mejoran la calidad de vida y provocan una mayor supervivencia en pacientes con enfermedades, como el cáncer (Cuevas et ál., 2016).
Actividad. Identificando mis aprendizajes
Los ECA son diseños que han permitido grandes avances en la clínica, pues son una herramienta metodológica individual muy poderosa para demostrar la efectividad de un tratamiento; sin embargo, también pueden presentar sesgos, por lo que es necesaria una lectura crítica de los resultados para su adecuada aplicación en la práctica clínica.
Autoevaluación. Haciéndolo real: estudio de caso
Como lo revisamos a lo largo de la UAPA, es fundamental contar con medidas que nos permitan evaluar las asociaciones que se establecen entre variables de exposición, por ejemplo, un nuevo fármaco, y eventos de interés, por ejemplo, alivio de los síntomas o curación de la enfermedad.
 Fuentes de información
Fuentes de información
Bibliografía
- Bradford, A. (1962). Statistical methods in clinical and preventive medicine. E. and S. Livingstone.
- Calva-Mercado, J. J. (2020, 8 de junio). Estudios clínicos experimentales. Salud Pública de México, 42(4), 349-358.
- Carrasco-Chinchilla, F., Cortés, J. y Jiménez-Navarro, M. F. (2013, octubre-diciembre). Diferentes tipos de estudios epidemiológicos: ventajas e inconvenientes. Cardiocore, 48(4), 133-135.
- Cobos-Carbó, A. y Augustovski, F. (2011, julio). Declaración CONSORT 2010: actualización de la lista de comprobación para informar ensayos clínicos aleatorizados de grupos paralelos. Medicina Clínica, 137(5), 213-215.
- Collier, J. (1995, 30 de septiembre). Confusion over use of placebo in clinical trials. The BMJ, 31(7009), 821-822.
- Cuello, C. A. y Pérez, G. (2015). Medicina basada en la evidencia. Médica Panamericana.
- Cuevas, O. L., Molina, A. M. y Fernández, D. R. (2016, enero-febrero). Los ensayos clínicos y su impacto en la sociedad. MediSur, 14(1), 13-21.
- D’Arcy, P. (1999, 28 de agosto). A change in scientific approach: from alternation to randomized allocation in clinical trials in the 1940s. The BMJ, 319(7209), 572-573.
- Demirdjian, G. (2006, enero-febrero). Historia de los ensayos clínicos aleatorizados. Archivos Argentinos de Pediatría, 104(1), 58-67.
- Estrada, S., Arancibia, M., Stojanova, J. y Papuzinski, C. (2020, 8 de abril). Conceptos generales en bioestadística y epidemiología clínica: estudios experimentales con diseño de ensayo clínico aleatorizado. Medwave, 20(2), e7869.
- Hernández, M., Lazcano, E. y Oropeza, C. (2021). Epidemiología. Diseño y análisis de estudios (2.a ed.). Instituto Nacional de Salud Pública.
- Hernández-Ávila, M., Garrido-Latorre, F. y López-Moreno, S. (2000, marzo-abril). Diseño de estudios epidemiológicos. Salud Pública de México, 42(2), 144-154.
- Jüni, P., Altman, D. G. y Egger, M. (2001, 7 de julio). Systematic review in health care: assessing the quality of controlled clinical trials. The BMJ, 323(7303), 42-46.
- Karlberg, J. P. E. y Speers, M. A. (2020). Revisión de ensayos clínicos: una guía para el Comité de Ética. Centro de Ensayos Clínicos-Universidad de Hong Kong/Asociación de Acreditación de los Programas de Protección para la Investigación en Seres Humanos.
- Lazcano-Ponce, E., Salazar-Martínez, E., Gutiérrez-Castrellón, P., Ángeles-Llerenas, A., Hernández-Garduño, A. y Viramontes, J. L. (2004, 11 de noviembre). Ensayos clínicos aleatorizados: variantes, métodos de aleatorización, análisis, consideraciones éticas y regulación. Salud Pública de México, 46(6), 559-584.
- Manterola, C. y Otzen, T. (2015, septiembre). Valoración clínica del riesgo, interpretación y utilidad práctica. International Journal of Morphology, 33(3), 842-849.
- Molina-Arias, M. (2012, 12 de diciembre). Cálculo de la reducción del riesgo y el número necesario de pacientes a tratar. Revista de Pediatría de Atención Primaria, 14(56), 369-372.
- Moreno, L., Cano, F. y García, H. (1994). Epidemiología clínica. McGraw-Hill Interamericana.
- Peto, R. y Baigent, C. (1998, 31 de octubre). Trials: the next 50 years. Large scale randomised evidence of moderate benefits. The BMJ, 217(7167), 1170-1171.
- Ramírez, I. y Cabrera, C. (2003, enero-febrero). La bioética y el uso de placebo en ensayos clínicos controlados. Revista Médica del Instituto Mexicano del Seguro Social, 41(1), 65-73.
- Ranganathan, P., Pramesh, C. S. y Aggarwald, R. (2016, enero-marzo). Common pitfalls in statistical analysis: absolute risk reduction, relative risk reduction and number needed to treat. Perspective in Clinical Research, 7(1), 51-53.
- Reeves, J. J., Shannon, M. W. y Fleisher, G. R. (2002, abril). Ondansetron decreases vomiting associated with acute gastroenteritis: a randomized controlled trail. Pediatrics, 109(4), e62.
- Rodríguez, M., Méndez, R., Marrero, R. y Arboláez, M. (2016, 3 de octubre). Ensayos clínicos controlados, una actividad en ascenso en la provincia de Villa Clara. Acta Médica del Centro, 10(4), 2-11.
- Rodríguez, H. H., Reyes, R. A. M. y Martínez, A. G. (2006). Diseño y análisis de ensayos clínicos. En N. Méndez-Sánchez, A. Villa y E. M. Uribe (Eds.). Métodos clínicos y epidemiológicos de investigación médica (pp. 378-384). Elsevier.
- Rothman, K. J. (1996, 6 de julio). Placebo mania. The BMJ, 313(7048), 3-4.
- Traversa, G. y Bignami, G. (1998, julio). Ethics problems in phase IV of drug studies. Annali dell'Istituto Superiore di Sanità, 34(2), 203-208.
- World Medical Association. (2000). Declaration of Helsinki. Autor.
- Zurita-Cruz, J. N., Márquez-González, H., Miranda-Novales, G. y Villasis-Keever, M. Á. (2018, abril-junio). Estudios experimentales: diseños de investigación para la evaluación de intervenciones en la clínica. Revista Alergia México, 65(2), 178-186.
Cómo citar
Ponciano-Rodríguez, M. G. (2024). Los clásicos de la epidemiología: ensayos clínicos aleatorizados (ECA). Unidades de Apoyo para el Aprendizaje. CUAED/Facultad de Medicina-UNAM. [Vínculo]