Los Clásicos de la Epidemiología: Implicaciones Éticas de los Ensayos Clínicos Aleatorizados (ECA)
Unidad de Apoyo para el Aprendizaje
IniciarLos Clásicos de la Epidemiología: Implicaciones Éticas de los Ensayos Clínicos Aleatorizados (ECA)
Unidad de Apoyo para el Aprendizaje
IniciarLa ética —del griego ethikós que significa “carácter”— es una rama de la filosofía que estudia el análisis sistemático y crítico de los factores morales que guían la conducta humana en una determinada práctica, en este caso en la medicina, hacia comportamientos deseables; permite diferenciar lo correcto de lo incorrecto. Entre los valores éticos más relevantes, se pueden mencionar los siguientes: justicia, libertad, respeto, responsabilidad, integridad, lealtad, honestidad y equidad.
La investigación clínica que utiliza seres humanos ha brindado grandes beneficios a la medicina; por ejemplo, es el origen de la generación de vacunas que han salvado millones de vidas; desafortunadamente, muchos estudios de este tipo han tenido una ética cuestionable: vulneran los derechos humanos y, en algunos casos, han causado daño físico y psicológico importante a los participantes. Esto ha determinado la necesidad imperiosa de crear estrategias que protejan la salud, la dignidad y la integridad de los participantes, a través de códigos y manuales.
En una gran contradicción, el primer código sobre ensayos clínicos e investigación en humanos fueron las directivas de sanidad del Ministerio de Sanidad del Reich alemán en 1931. Evidentemente, éstas no se aplicaron durante la Segunda Guerra Mundial, pues, en los campos de concentración alemanes, se cometieron atrocidades con seres humanos, considerados de una “raza inferior”, como los judíos y los gitanos.
Al finalizar la guerra y con el triunfo de los aliados, se descubrieron esas atrocidades y, en la ciudad alemana de Nuremberg, se realizó el juicio de los médicos nazis que se lograron apresar, aunque el gran orquestador de los horrores de la guerra en Auschwitz, Josef Mengele, nunca fue encontrado.
En esta UAPA, revisaremos algunos aspectos éticos importantes de los estudios en los que se incluyen seres humanos.
Ante la difusión de los atroces experimentos con humanos realizados durante la Segunda Guerra Mundial, surge el Código de Nuremberg:
El Código de Nuremberg establece, en 1947, las primeras normas éticas de carácter universal; fue la piedra fundacional de la regulación contemporánea, que incorpora el consentimiento informado como herramienta protectora de la autonomía individual, a través de 10 puntos sobre la ética de experimentación en humanos (Lema et ál., 2013).
El Código de Nuremberg fue una expresión clara de la asociación entre la ética médica y los derechos humanos, cuya declaración universal sería aprobada el año siguiente. A continuación, revisaremos los acontecimientos más destacados, posteriores a la publicación de dicho código que sentaron las bases para la Declaración de Helsinki.
Aunque es cierto que la última actualización de la Declaración de Helsinki incluye varios principios que inciden en una mayor protección de los sujetos que participan en la investigación, representando una mejoría significativa sobre versiones previas, todavía contiene principios que requieren clarificación y una mayor exigencia de protección de los derechos, seguridad y bienestar de los participantes en la investigación.
Una guía de principios éticos universales debe garantizar una investigación biomédica con las máximas garantías de respeto a los derechos, seguridad y bienestar de los sujetos participantes, sobre todo en grupos especialmente vulnerables.
Otro hecho importante que ha determinado el contenido de las normativas es el impulso que comenzaron a tener las investigaciones financiadas por países o compañías farmacéuticas del primer mundo sobre países en vías de desarrollo, aplicando un doble estándar ético para analizar y evaluar la experimentación; por ejemplo, en el año 2000, se denunciaron investigaciones no éticas efectuadas en naciones en desarrollo, donde se pueden realizar con más rapidez, por falta de regulación y con menor costo y menor oposición de los pacientes, que, necesitados de medicamentos, firmarán el consentimiento informado con mayor facilidad (Schuklenk y Ashcroft, 2000).
En conclusión, podemos decir que estos códigos son la expresión de un consenso racional entre naciones para la generación de conocimiento mediante los ECA, en el cual el cuidado y bienestar de las personas siempre deberá encontrarse por encima de los intereses individuales y económicos.
Si quieres consultar la Declaración de Helsinki y la posición de la Comisión Nacional de Bioética, puedes consultar la siguiente liga:
https://www.conbioetica-mexico.salud.gob.mx/descargas/pdf/helsinki.pdf
Para consultar esta declaración en el sitio de la AMM, puedes seguir esta liga:
Los médicos nazis realizaron crímenes contra la humanidad disfrazados de investigaciones científicas; por ejemplo, pruebas de sobrevivencia al ayuno, congelamiento, respuesta a grandes altitudes, a radiación, mutilaciones quirúrgicas, exposición a gases tóxicos y actos de esterilización y eugenesia; asimismo, indujeron heridas y quemaduras graves en los prisioneros para observar los efectos de la gangrena (Pressel, 2003; Tealdi, 2006). Evidentemente, la mayoría de los participantes en estos experimentos fallecieron. En Japón, también durante la guerra, se efectuaron terribles experimentos con prisioneros a quienes se les inoculaba con diferentes bacterias para producirles padecimientos, como el botulismo, tifo, difteria y otras graves enfermedades infecciosas.
A pesar de la existencia ya de los principios éticos del Código de Nuremberg, en la posguerra, se tiene evidencia de casos en los cuales se omitieron estos preceptos y donde no se respetó la dignidad intrínseca de todo ser humano.
En el caso del Willowbrook State School, en 1956, se estudió́ la historia natural de la hepatitis A, inoculando deliberadamente el virus a niños con retardo mental.

Wikipedia. (2017). Willowbrook State School [fotografía]. Tomada de https://commons.wikimedia.org/wiki/File:Willowbrook_State_School_(NYPL_b15279351-105038)_-_cropped.jpg. [Escuela en donde se realizó un inescrupuloso estudio médico sobre hepatitis A.]
En el caso del Jewish Chronic Disease Hospital, en 1963, se inyectaron células cancerosas de forma subcutánea a pacientes ancianos (Beecher, 1966).
Freepik. (s. f.). Centro de vacunación con médico y paciente [fotografía]. Tomada de https://www.freepik.es/foto-gratis/centro-vacunacion-medico-paciente_14482192.htm#fromView=search&page=2&position=16&uuid=2e0501bb-98c4-4c13-a8d1-da076bf8c7aa
En el caso de Tuskegee, en Alabama, se realizó una investigación de 40 años de duración, finalizada en 1972, donde se utilizó a 400 hombres afroamericanos para estudiar la historia natural de la sífilis y sus complicaciones, a pesar de que, en 1941, ya existía la penicilina como tratamiento disponible, en casos de neurosífilis, así como de sífilis congénita (Thomas y Quinn, 1991; Franca et ál., 1998).

Department of Health, Education, and Welfare. (2010). Un médico del estudio inyecta placebo, en lugar de medicamento, a una de las víctimas del experimento Tuskegee [fotografía]. Tomada de https://es.wikipedia.org/wiki/Experimento_Tuskegee#/media/Archivo:Tuskegee-syphilis-study_doctor_injects_subject_with_placebo.gif
Lurie y Wolfe (1997) denunciaron que los grupos de control habían sido tratados con placebo en estudios de transmisión vertical de VIH en África y República Dominicana y de infección tuberculosa en pacientes VIH-positivos en Uganda y Haití. Los patrocinadores de estas investigaciones habían sido el Department of Human Health Services, los Institutos Nacionales de Salud y el Centro de Control de Enfermedades de Atlanta, todos de Estados Unidos de Norteamérica. El argumento para realizar los estudios de esta forma fue que el “no tratamiento” era el estándar local. Esta información adquiere una mayor relevancia, puesto que, tres años antes (1994), se había comprobado que el tratamiento con zidovudina en embarazadas reduce la infección vertical.

Pressfoto. (s. f.). Científico que realiza investigación [fotografía]. Tomada de https://www.freepik.es/foto-gratis/cientifico-que-realiza-investigacion_6766484.htm#fromView=search&page=1&position=4&uuid=929a3414-a2de-4e1d-a4b7-1725fd998cd1
Como lo hemos revisado, a lo largo de la historia, se han hecho múltiples violaciones a la ética; entre ello, hay algo que se conoce como “doble estándar”.
El doble estándar es un tipo de terapia para países desarrollados y otra para países en vías de desarrollo, lo cual es inequitativo para las naciones más pobres (Angell, 1997).
Por ello, varios autores solicitaron urgentemente la revisión de la Declaración de Helsinki en este aspecto (Levine, 1990), el cual es muy controvertido, ya que algunos autores mencionan que la industria farmacéutica maneja este argumento como si sus hallazgos fueran a beneficiar a los países de bajos y medianos ingresos, lo cual no es cierto, en razón de que el precio de muchos fármacos llega a ser no costeable para personas de bajos ingresos. De esta forma, resulta inaceptable que se realicen ECA en población pobre de África o América Latina, así como la existencia de organismos privados que avalen los ECA como una forma de generar ganancias económicas.
Un experimento clínico realizado en humanos se justifica por los beneficios que puede traer tanto a quienes participan en el ECA como en otros grupos de individuos. La esencia de este diseño es que el investigador decide cuáles individuos serán sometidos a la intervención —grupo experimental— y quiénes estarán en el grupo comparativo —grupo de control—; es decir, manipula a su voluntad las variables, por lo que la asignación de la maniobra experimental —no solamente medicamentos; también pueden ser procedimientos quirúrgicos, programas educativos, régimen dietético, etc.— debe seguir ciertos lineamientos. Uno de los más importantes es el consentimiento informado (CI).
El CI consiste en una decisión de participar en una investigación hecha por un individuo competente que ha sido enterado con la información necesaria, la ha comprendido adecuadamente y, después de considerarla, ha llegado a una decisión sin haber sido sometido a coerción, intimidación ni a influencias o incentivos indebidos (Council for International Organizations of Medical Sciences, 2002).

Freepik. (s. f.). Vista lateral del paciente rellenando el documento de consentimiento [ilustración]. Tomada de https://www.freepik.es/foto-gratis/vista-lateral-paciente-rellenando-documento-consentimiento_34728746.htm#page=2&query=consulta&position=41&from_view=search&track=sph
De forma ideal, la decisión de participar en un ensayo es un proceso que incluye la discusión del estudio con el investigador principal (IP), así como con otros colaboradores, además de la garantía de que esta información fue comprendida adecuadamente por el participante para que el sujeto o su representante legal otorguen la firma en el documento de CI.
A continuación, se presentan los componentes del CI que han sido estandarizados por organizaciones internacionales (Lazcano-Ponce et ál., 2004):
Para ver los criterios que debe cumplir una carta de CI, visita la siguiente liga de la Comisión Nacional de Arbitraje Médico:
Privacidad y confidencialidad
Una preocupación importante en los ECA es la protección de la privacidad y la confidencialidad de los participantes.
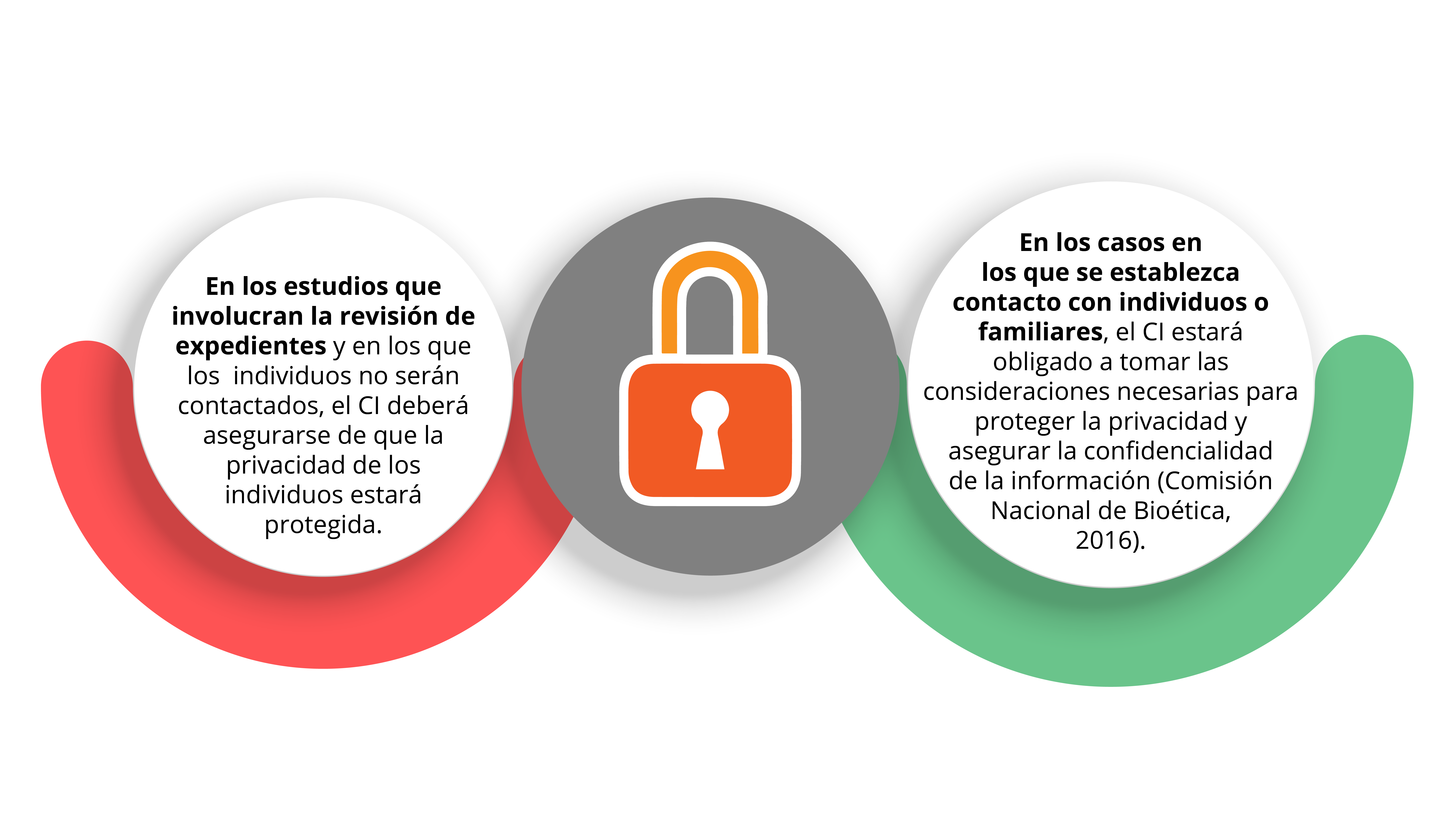
Así como los pacientes en atención clínica, los participantes en investigación tienen derecho a la privacidad de sus datos personales de salud; sin embargo, debe especificarse cómo esos datos deberán utilizarse al dar a conocer el resultado del estudio en el CI. Como regla general, la información deberá ser anónima —por ejemplo, usando claves y no el nombre completo del participante—, almacenarse y transmitirse de forma segura.
En México, el Reglamento de la Ley General de Salud en Materia de Investigación contempla en su artículo 99 que:
Toda institución de salud en donde se realice investigación clínica con humanos deberá tener un Comité de Ética en Investigación (CEI) que revise cuidadosamente el protocolo.
De acuerdo con las guías operativas que evalúan la investigación biomédica, propuestas por la OMS, el propósito de un CEI es contribuir a salvaguardar la dignidad, derechos, seguridad y bienestar de todos los y las participantes actuales y potenciales de la investigación (Gilbert et ál., 1989). Según nuestra legislación, la Ley General de Salud establece en sus artículos 41 bis y 98 que los CEI son:
Órganos colegiados autónomos, institucionales, interdisciplinarios, plurales y de carácter consultivo, creados para evaluar y dictaminar protocolos de investigación en seres humanos.
Los CEI tienen la función de abordar las siguientes cuestiones (Torgerson y Dumville, 2004; Lazcano-Ponce et ál., 2004):
El CEI revisa y aprueba o rechaza el protocolo; además, verifica que los investigadores sean idóneos para llevar a cabo el estudio, que las instalaciones sean adecuadas y los métodos y materiales que se utilizarán para obtener y documentar el CI de los participantes sean apropiados (Karlberg y Speers, 2020). Los eventos adversos relacionados con la investigación deben ser reportados al CEI, cuando sean graves, dentro de las primeras 24 horas de conocido el evento.
Toda propuesta de investigación médica en seres humanos debe ser revisada y aprobada por un CEI independiente antes de realizarla (Comisión Nacional de Bioética, 2016).
Otro aspecto ético importante que se ha discutido en estos estudios es el uso del placebo, especialmente en padecimientos como el cáncer; a continuación, abordaremos este tema.
El placebo es un agente farmacológicamente inactivo que se administra en el grupo de control de los ECA; es un tratamiento inerte que no le permite recibir a este grupo los efectos favorables del tratamiento que se administra al grupo experimental.
El placebo tiene una apariencia similar a los tratamientos que se están empleando, pero sin su actividad específica. Los ECA en los que se utiliza placebo siempre han sido controversiales, pues a los participantes que aleatoriamente conforman este grupo se les priva del tratamiento efectivo (Emanuel y Miller, 2001).
Freepik. (s. f.). Vista superior de tabletas médicas sobre la mesa [fotografía]. Tomada de https://www.freepik.es/foto-gratis/vista-superior-tabletas-medicas-sobre-mesa_7946237.htm#fromView=search&page=1&position=3&uuid=597bb128-fcc8-449d-beb2-eb7ed88dc4b3
El uso del placebo ha reportado resultados objetivos y subjetivos en un rango de 30-40 % de los pacientes en ECA en los que se estudian entidades clínicas como dolor, asma, hipertensión arterial e, incluso, infarto al miocardio (Kienle y Kiene, 1997).
Se ha documentado desde la década de los cincuenta que el uso del placebo tiene un efecto terapéutico real, bajo mecanismos desconocidos, en más del 30 % de los casos (Beecher, 1955); sin embargo, la discusión continúa al usar placebo, a pesar de la existencia de un tratamiento efectivo, pues se violan principios básicos de la Declaración de Helsinki, que establece que el placebo solamente podrá utilizarse en ausencia de una terapia existente y probada en las siguientes situaciones:
Por razones metodológicas y científicas, para determinar la seguridad y eficacia de un método profiláctico, diagnóstico o terapéutico.
Cuando la intervención se realiza para investigar una enfermedad leve, (Ferriman, 2001) o si el método profiláctico, diagnóstico o tratamiento es investigado para una entidad clínica menor.
Cuando los sujetos de la investigación no serán objeto de algún riesgo adicional o daño irreversible (Lazcano-Ponce et ál., 2004).
Podría ser ético el uso de placebo, aun cuando exista un tratamiento probado, si hay fuertes razones científicas y metodológicas que hicieran necesario determinar la eficacia o la seguridad de la intervención y cuando ésta se realiza para investigar una enfermedad leve y los participantes que reciben el placebo no se exponen a riesgos adicionales, daño irreversible o serio (Ferriman, 2001). Así pues, las razones científicas para el uso de placebo en estudios con grupo de control son complejas y pueden ser contradictorias:
Desde el punto de vista ético, también existen interrogantes, ya que siempre es importante preguntarse lo siguiente:
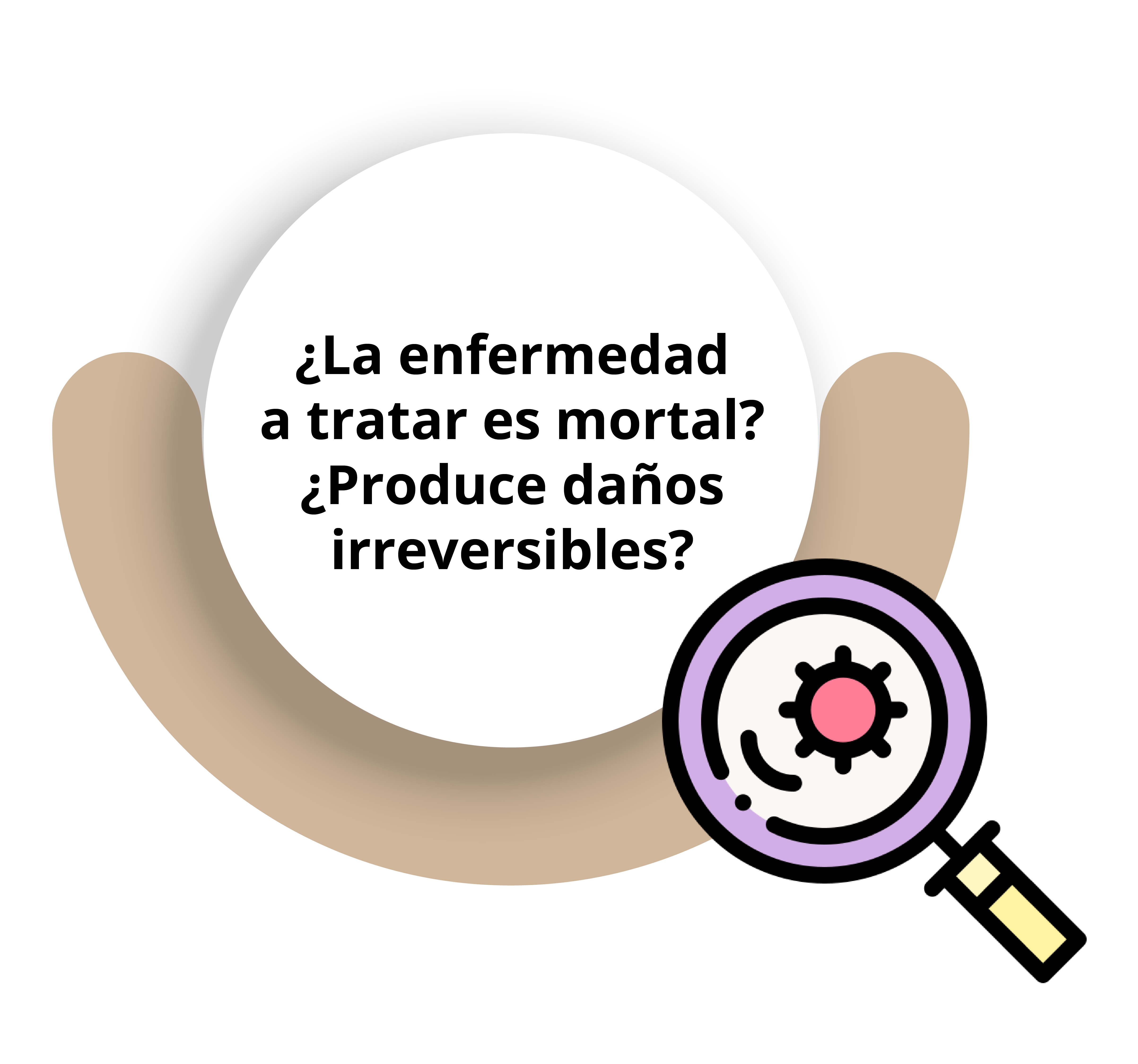
Si las respuestas son positivas, entonces, no habría aprobación ética para el uso de un placebo; se parte del principio de equidad sin el cual todo ECA sería no ético (Rothman y Michels, 1994). Respecto a este tema, la Organización Médica Mundial (WMA, por sus siglas en inglés), en su reporte del 2001 sobre la Declaración de Helsinki, establece:
Las BPC son estándares para el diseño, conducción, desarrollo, monitoreo, auditoría, registro, análisis y reporte de ECA.
Su cumplimiento asegura dos aspectos (Lazcano-Ponce et ál., 2004):
Asimismo, para poder evaluar la metodología de un ECA, así como sus planteamientos éticos a partir de su publicación, es preciso que se describan detalladamente, con exactitud y con transparencia, su diseño, ejecución, análisis y resultados; sin embargo, la información facilitada en las publicaciones es, muchas veces, insuficiente o inexacta. Estas carencias motivaron el desarrollo de la declaración CONSORT (acrónimo de consolidated standards of reporting trials) en 1996.
La declaración CONSORT 2010 consta de una lista de comprobación de 25 ítems que se consideran críticos.
Estos ítems deberían incluirse en todo informe de un ensayo clínico, junto con un diagrama para ilustrar el flujo de individuos participantes a lo largo del ensayo (Cobos-Carbó y Augustovski, 2011):
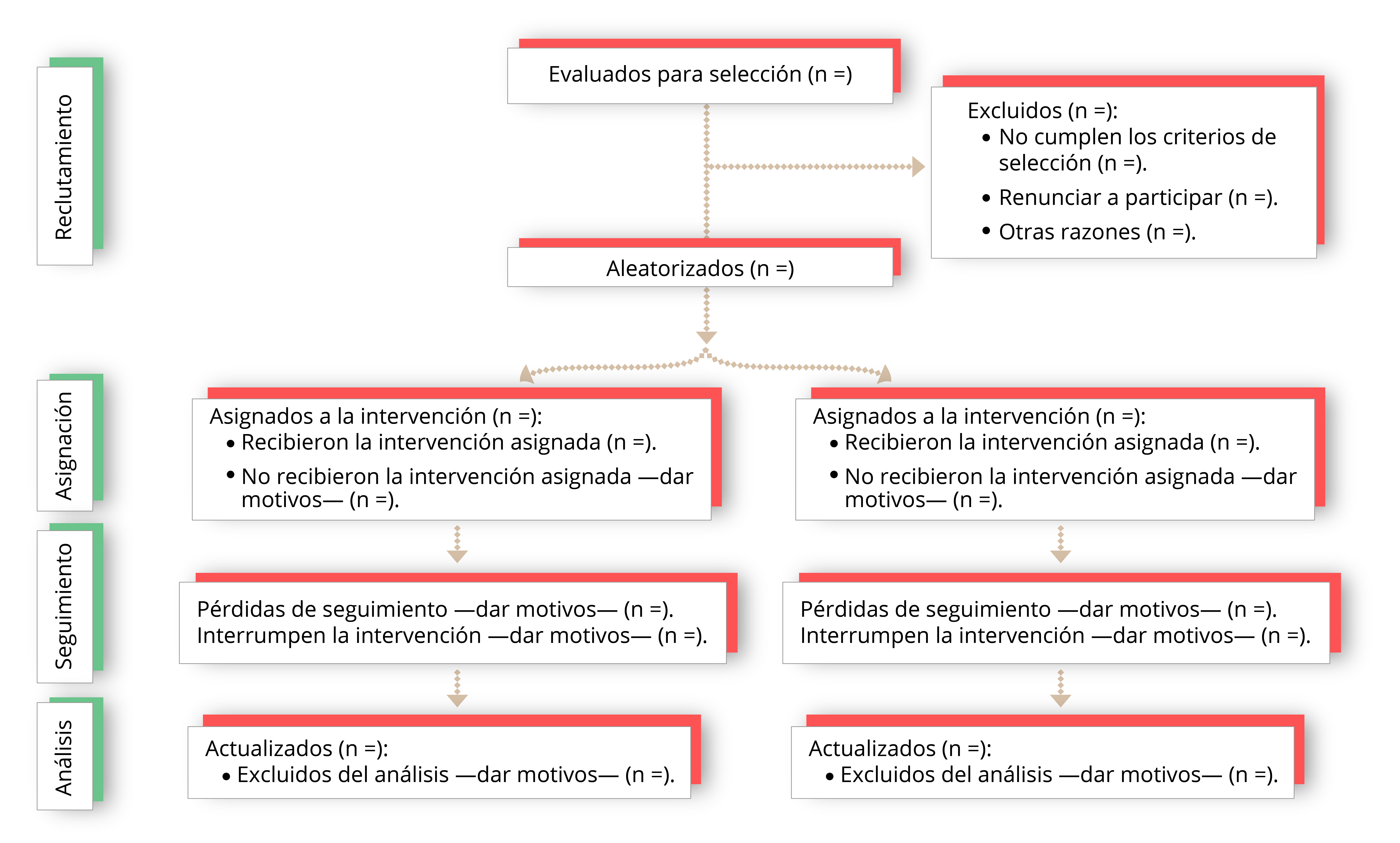
Diagrama de flujo del progreso a través de las fases de un ECA paralelo de dos grupos
Los ECA han permitido el avance de la medicina clínica, al proporcionar una herramienta para poder probar la eficacia y seguridad de nuevos tratamientos; actualmente, son el estándar de oro o paradigma en la evaluación de la utilidad de nuevos tratamientos.
A pesar de no ser infalibles y de, en ocasiones, resultar cuestionables los estudios experimentales, especialmente desde el punto de vista ético, han contribuido enormemente en la evolución hacia terapias y medidas profilácticas más eficaces y seguras.
Los ECA constituyen el diseño más completo de investigación epidemiológica, son los más cercanos al método experimental y proporcionan una firme evidencia de causalidad, pues el investigador tiene el control de la exposición; son prospectivos y, en teoría, se pueden evitar sesgos con ellos y generan una gran cantidad de información; sin embargo, son costosos y logísticamente complejos; por ejemplo, cuando se trata de evaluar un nuevo medicamento, debe hacerse teniendo información completa de su farmacología —farmacocinética y farmacodinamia—, su toxicidad y datos preliminares de su posible eficacia. Lo mismo sucede cuando se prueban nuevas intervenciones clínicas.
Además, los ECA plantean dilemas éticos que pueden llegar a ser de difícil solución; por ejemplo, no ofrecer a los participantes la mejor opción terapéutica conocida, o bien, utilizar un medicamento del que se tienen dudas sobre sus eventos adversos severos, así como cuándo usar placebo.
En la realidad, llevar a cabo ECA con alta calidad y siguiendo todas las reglas metodológicas y de ética no es sencillo, especialmente en países donde la infraestructura física y humana para llevarlos a cabo presenta carencias; cabe enfatizar que, además de priorizar los aspectos relacionados con la metodología, es fundamental respetar los derechos de los participantes, aplicando estrictamente los códigos de ética.
El hecho de experimentar nuevas alternativas de tratamiento en seres humanos conlleva a cuestionamientos éticos en los que es fundamental sopesar el riesgo-beneficio y establecer que los participantes deben dar su consentimiento libre, de manera voluntaria y sin coacción, una vez que hayan sido informados ampliamente de los objetivos, beneficios y riesgos del estudio en el que van a participar.
Es momento de que valores qué tanto has aprendido a lo largo de esta UAPA.
Fuentes de información
Bibliografía
Angell, M. (1997, 18 de septiembre). The ethics of clinical research in the third world. The New England Journal of Medicine, 337(12), 847-849.
Beecher, H. K. (1955, 24 de diciembre). The powerful placebo. Journal of the American Medical Association, 159(17), 1602-1606.
Beecher, H. K. (1966, 16 de junio). Ethics and clinical research. The New England Journal of Medicine, 274(24), 1354-1360.
Cobos-Carbó, A. y Augustovski, F. (2011, julio). Declaración CONSORT 2010: actualización de la lista de comprobación para informar ensayos clínicos aleatorizados de grupos paralelos. Medicina Clínica, 137(5), 213-215.
Comisión Nacional de Bioética. (2016). Guía nacional para la integración y el funcionamiento de los Comités de Ética en Investigación (5.a ed.). Autor.
Council for International Organizations of Medical Sciences. (2002). International Ethical Guidelines for Biomedical Research Involving Human Subjects. Autor.
De Abajo, F. J. (2001, septiembre-octubre). La declaración de Helsinki VI: una revisión necesaria, pero ¿suficiente? Revista Española de Salud Pública, 75(5), 407-414.
Emanuel, E. J. y Miller, F. G. (2001, 20 de septiembre). The ethics of placebo-controlled trials-a middle ground. The New England Journal of Medicine, 345(12), 915-919.
Ferriman, A. (2001, 13 de octubre). World Medical Association clarifies rules on placebo controlled trials. The BMJ, 323(7317), 825.
Franca, O. E., Añón, F. R., García, C., Núñez, J., Wodowoodz, O., Queirolo, E. I. y Grauert, R. (1998, diciembre). Ética en la investigación clínica: una propuesta para prestarle la debida atención. Revista Médica del Uruguay, 14(3), 192-201.
Gamble, V. N. (1997, noviembre). Under the shadow of Tuskegee: African Americans and health care. American Journal of Public Health, 87(11), 1773-1778.
Gilbert, C., Fulford, K. W. y Parker, C. (1989, 9 de diciembre). Diversity in the practice of district ethics committees. The BMJ, 299(6713), 1437-1439.
Karlberg, J. P. E. y Speers, M. A. (2020). Reviewing clinical trials: a guide for the ethics committee. Pfizer.
Kienle, G. S. y Kiene, H. (1997, diciembre). The powerful placebo effect: fact or fiction. Journal of Clinical Epidemiology, 50(12), 1311-1318.
Lazcano-Ponce, E., Salazar-Martínez, E., Gutiérrez-Castrellón, P., Ángeles-Llerenas, A., Hernández-Garduño, A. y Viramontes, J. L. (2004, 11 de noviembre). Ensayos clínicos aleatorizados: variantes, métodos de aleatorización, análisis, consideraciones éticas y regulación. Salud Pública de México, 46(6), 559-584.
Lema, S., Toledo, S., Carracedo, M. R. y Rodríguez, H. (2013, diciembre). La ética de la investigación en seres humanos en debate. Revista Médica del Uruguay, 29(4), 242-247.
Levine, R. J. (1990, 12 de agosto). The need to revise the Declaration of Helsinki. The New England Journal of Medicine, 341(7), 531-534.
Lurie, P. y Wolfe, S. M. (1997, 18 de septiembre). Unethical trials of interventions to reduce perinatal transmission of the human immunodeficiency virus in developing countries. The New England Journal of Medicine, 337(12), 853-856.
Pressel, D. M. (2003, diciembre). Nuremberg and Tuskegee: lessons for contemporary American medicine. Journal of the National Medical Association, 95(12), 1216-1225.
Ramírez, I. y Cabrera, C. E. (2003, enero-febrero). La bioética y el uso de placebo en ensayos clínicos controlados. Revista Médica del Instituto Mexicano del Seguro Social, 41(1), 65-73.
Rothman, K. J. y Michels, K. B. (1994, 11 de agosto). The continuing unethical use of placebo controls. The New England Journal of Medicine, 331(6), 394-398.
Schuklenk, U. y Ashcroft, R. (2000, abril). International research ethics. Bioethics, 14(2), 158-172.
Tealdi, J. C. (2003, septiembre). Ética de la investigación: el principio y el fin de la bioética. Summa Bioética, (esp.), 69-72.
Thomas, S. B. y Quinn, S. C. (1991, noviembre). The Tuskegee Syphilis Study 1932 to 1972: implications for HIV education and AIDS risk education programs in the black community. American Journal of Public Health, 81(11), 1498-1505.
Torgerson, D. J. y Dumville, J. C. (2004, 20 de marzo). Ethics review in research: research governance also delays research. The BMJ, 328(7441), 710.
Imagen de portada
Freepik. (s. f.). Vista superior del concepto de elecciones con espacio de copia [fotografía]. https://www.freepik.es/foto-gratis/vista-superior-concepto-elecciones-espacio-copia_7646400.htm#fromView=search&page=7&position=22&uuid=75a24435-af37-4dc6-b99a-cf1fbc2e8466
Cómo citar
Ponciano-Rodríguez, M. G., Cortés-Meda, A., Fernández-Sánchez, E. y Rojas-Limón, I. E. (2024). Los clásicos de la epidemiología: implicaciones éticas de los ensayos clínicos aleatorizados (ECA). Unidades de Apoyo para el Aprendizaje. CUAED/Facultad de Medicina-UNAM. [Vínculo]