Tradicionalmente, se ha asociado la obesidad con un exceso en el consumo de grasas, pero ésta no es toda la historia; entre otros factores, también cuentan los genes.
La existencia de componentes genéticos y epigenéticos de la obesidad se ha investigado desde hace mucho tiempo, por ejemplo, sobre niños adoptados y hermanos gemelos univitelinos, intentando distinguir las influencias ambientales de las hereditarias.
El resultado final es que los hijos biológicos de padres obesos tienden a ser obesos y los gemelos idénticos, con independencia de que hayan crecido o no en el mismo entorno ambiental, se parecen mucho entre sí, respecto a sus características corporales, incluyendo la naturaleza de sus reservas en grasas y sus respuestas metabólicas a la sobrealimentación.
Por otra parte, esta condición favorece la aparición de otros factores importantes de riesgo: diabetes, hipertensión, hiperlipidemia y ciertos tipos de cáncer.
La obesidad se presenta cuando cantidades anormales de triglicéridos se almacenan en los tejidos adiposos y se liberan de estos tejidos como ácidos grasos libres, con efectos perjudiciales a la salud. El exceso de acumulación de grasa se da cuando la ingesta calórica sobrepasa la cantidad de energía gastada; cada individuo responde de manera diferente a este desbalance, y la respuesta normalmente está relacionada a la predisposición genética del individuo.
En 1994, en la revista científica Nature, el genetista J. M. Friedman y otros colegas del Howard Hughes Medical Institute de la Rockefeller University publicaron sus investigaciones sobre los aspectos genéticos de la obesidad.
¿Qué es lo que realmente descubrió Friedman? En ratones, identificó, aisló y clonó el gen ob (obeso); es decir, el gen cuya mutación hace que se ocasione la obesidad severa hereditaria de esos animales.
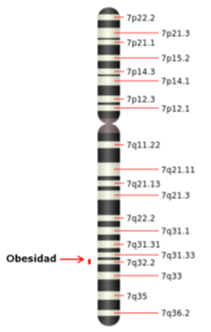
Cromosoma 7
El gen se encuentra en un segmento del cromosoma 6 de los ratones y en el cromosoma 7 de los humanos; posee la información para cifrar la síntesis de la hormona leptina, que se ha comprobado se sintetiza principalmente en el tejido adiposo y en otros tipos de tejidos. La hormona leptina, de naturaleza proteínica, actúa como un termostato: cuando la cantidad de grasa almacenada en los adipocitos aumenta, se libera leptina en el flujo sanguíneo, lo que constituye una señal que informa al hipotálamo que el cuerpo tiene bastantes reservas y que debe inhibirse el apetito.
En los ratones portadores, las mutaciones en el gen ob murino ocasionan que carezcan de leptina sérica y presenten un fenotipo de obesidad severa asociada a otros problemas, como menores temperatura corporal, actividad locomotora y actividad del sistema inmune, así como infertilidad. La administración de leptina exógena corrige estas alteraciones.
Este hecho hizo plantear la hipótesis de que la obesidad podría deberse a una mutación en el gen ob humano y, por tanto, la administración de leptina exógena podría ser la panacea en el tratamiento de la obesidad; sin embargo, esta idea se desvaneció al comprobar que esta mutación en la población obesa es extraordinariamente rara y que la gran mayoría de los pacientes obesos presenta altos niveles de leptina sérica.
Los pocos casos clínicos de humanos con deficiencia congénita de leptina se caracterizan por un fenotipo similar al hallado en los ratones ob/ob, con obesidad severa, hiperfagia e hiperinsulinemia.
Como se mencionó anteriormente, la leptina está íntimamente relacionada con la regulación del apetito, el metabolismo y el consumo de calorías; constituye el compuesto químico que le indica al cerebro humano cuándo está lleno el individuo y debe comenzar a quemar calorías, mediante la liberación de una serie de mensajes que parten del hipotálamo y terminan en la glándula tiroides, la cual controla la forma en que el cuerpo almacena y usa su energía.
La leptina es una hormona proteínica de 167 aminoácidos, que incluye un péptido señal de 21 aminoácidos. Su estructura tridimensional presenta cuatro hélices alfa y un puente disulfuro (S-S) entre las cisteínas, en posición 96 y 146; es este último necesario para la actividad biológica de la hormona.
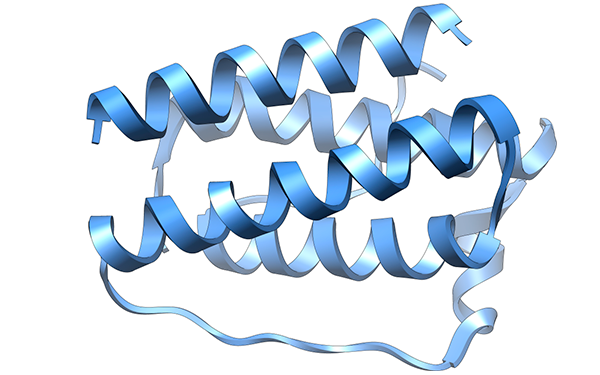
(s. a.) (2007). Estructura de la leptina [ilustración]. Tomada de http://commons.wikimedia.org/wiki/File:Leptin.png#mediaviewer/File:Leptin
Durante el sueño, los niveles de leptina aumentan, indicando al cerebro que se tiene suficiente energía por el momento y no existe necesidad de sentir hambre o de consumir calorías. Cuando no se duerme lo necesario, el cerebro detecta que no tenemos la suficiente energía para llevar a cabo nuestras actividades, de tal modo que se tiene hambre a pesar de que, en realidad, no requerimos alimentos en esos momentos y se almacenan las calorías en la forma de grasa para tener la suficiente energía cuando la necesitemos.
La disminución de leptina, ocasionada por la falta de sueño, puede resultar en un hambre constante y una disminución del metabolismo. La otra hormona que está relacionada al sueño y al peso corporal es la grelina (growth hormone release-inducing [ghrelin]), formada por 28 aminoácidos y, básicamente, tiene la acción contraria a la leptina: es la que le indica al cerebro cuándo se necesita comer, cuándo dejar de consumir calorías y cuándo almacenar la energía como grasa.
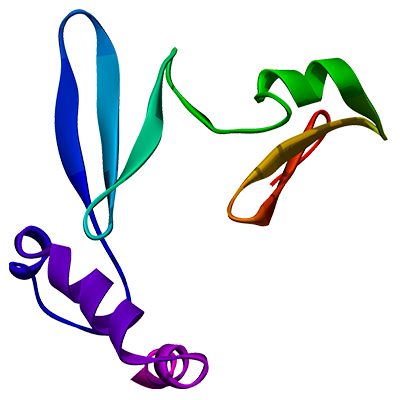
Almagro, M. (2016). Modelo teórico de la hormona grelina [ilustración]. Tomada de https://commons.wikimedia.org/wiki/File:Ghrelin-3D-predicted.png#/media/Archivo:Ghrelin-3D-predicted.png
Durante el sueño, los niveles de grelina disminuyen, ya que se requiere menos energía que cuando se está despierto. Por lo tanto, cuando no se duerme lo suficiente, se acumula demasiada grelina en el sistema y el cuerpo siente hambre y necesita más calorías.
La síntesis de la leptina ocurre principalmente, aunque no de forma excluyente, a nivel del tejido adiposo. Este hecho permitió proponer que la secreción de esta hormona actúa como señal al cerebro, informando sobre el tamaño del tejido adiposo y actuando como factor de saciedad.
Cuando aumenta la masa de tejido adiposo más allá del punto de equilibrio, aumenta la síntesis y secreción de la leptina, por lo que se estimulan varios efectos compensadores en el hipotálamo:
La regulación de la secreción de la leptina es a largo plazo, principalmente por variación del nivel de masa corporal y efectos estimulantes de la insulina; sin embargo, muchos obesos tienen altas concentraciones en suero o resistencia a ésta, lo que indica que otras moléculas, como la grelina, la serotonina, la colecistocinina y el neuropéptido, también tienen un efecto sobre la sensación de saciedad y contribuyen a la regulación del peso corporal.
La leptina y la grelina parecen ser los principales factores en la regulación del apetito, los cuales, consecuentemente, influyen en el peso corporal y cantidad de grasa. Ambas son señales periféricas con efecto central; o sea, son secretadas en otras partes del cuerpo —periferia—, pero afectan al cerebro —central—:
La leptina participa además en procesos fisiológicos tan diversos como en la reproducción, la inmunidad y la angiogénesis. El tejido adiposo de tipo “grasa parda” también sintetiza leptina, aunque en menor cantidad. La regulación de la expresión depende, en gran medida, de los depósitos grasos del organismo; así, los adipocitos de mayor tamaño producen más leptina, mientras que los de la grasa visceral secretan menos que los adipocitos de la grasa subcutánea.
La cantidad de triglicéridos almacenados en el adipocito es proporcional a la cantidad de leptina producida por cada adipocito. Por esta razón, los niveles circulantes de esta hormona son proporcionales a la cantidad de grasa corporal.
La secreción varía de acuerdo al ritmo circadiano; es secretada en forma pulsátil y modulada por la insulina y otras hormonas. Su concentración aumenta paulatinamente durante el día y alcanza un máximo durante la medianoche y decrece hasta el inicio de un nuevo ciclo.
Este patrón depende también de la alimentación. De esta forma, las concentraciones circulantes de leptina aumentan en las primeras horas después de la ingesta y continúan su ascenso en caso de una sobrealimentación, pero, en situaciones de ayuno, hay un descenso en la producción.
Por otro lado, parece que los cambios en el patrón de secreción asociados a la alimentación están más relacionados con la concentración plasmática de insulina que con el peso corporal. Una vez secretada al torrente circulatorio, la leptina circula unida parcialmente a proteínas plasmáticas y es la proporción de ésta, unida a proteínas, inferior en individuos obesos.
La eliminación de la leptina se lleva a cabo principalmente por vía renal y es metabolizada, en especial, por las células epiteliales renales, por lo que su concentración aumenta en pacientes que padecen insuficiencia renal.
Una vez que la leptina es secretada por el tejido adiposo al torrente sanguíneo, debe llegar a sus órganos blanco y ser reconocida por los receptores proteínicos en la superficie de la membrana plasmática.
El receptor Ob-R circula unido a la leptina y funciona como un regulador de la concentración de hormona libre. Los niveles séricos de leptina en personas con peso normal oscilan de 3-18 ng/ml; existen niveles más elevados en la mujer que en el hombre, aunque en individuos con un índice de masa corporal (IMC) superior a 30, se pueden encontrar valores de 30 ng/ml o, incluso, superiores.
El IMC es una medida de asociación entre el peso y la talla de un individuo, ideada por el estadístico belga Adolphe Quetelet, por lo que también se conoce como índice de Quetelet. Se calcula según la expresión matemática:
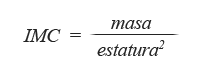
… donde la masa o peso se expresa en kilogramos y la estatura en metros; la unidad de medida del IMC en el sistema metro/kilogramo/segundo (MKS) es:
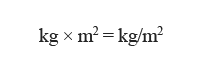
Se han detectado varios receptores para la leptina (Ob-R) en casi todos los tejidos y se han encontrado distintas isoformas, dependiendo del órgano blanco.

El estudio de Chen et ál. (1996), utilizando ratones db, confirmó la presencia de mutaciones de punto en los receptores hipotalámicos para la leptina y se observó que afectan a todas las isoformas, causando una fijación deficiente de la hormona o una mala transducción de la señal al interior de la célula. Aunque los estudios en humanos no han logrado encontrar mutaciones en los receptores para la leptina, recientemente, se informó de una familia a la que se le detectaron alteraciones en el receptor a la leptina (Ob-R); estos pacientes desarrollaron obesidad y anormalidades en el desarrollo sexual.
La leptina es secretada por los adipocitos, de tal forma que, en la sangre, es reflejo de las reservas grasas del cuerpo, estableciendo un circuito de retroalimentación negativa donde la leptina circulante inhibe, en el núcleo arcuato del hipotálamo, la producción del neuropéptido Y (NPY).
Las moléculas de leptina pueden atravesar la membrana hematoencefálica, pero también pueden ser captadas desde el líquido cefalorraquídeo. En el núcleo hipotalámico, se produce el NPY que aumenta la ingesta y disminuye la termogénesis. El principal mecanismo por el que la leptina regula el apetito es, por tanto, inhibiendo la síntesis y la secreción del NPY, que se produce a nivel del núcleo arqueado.
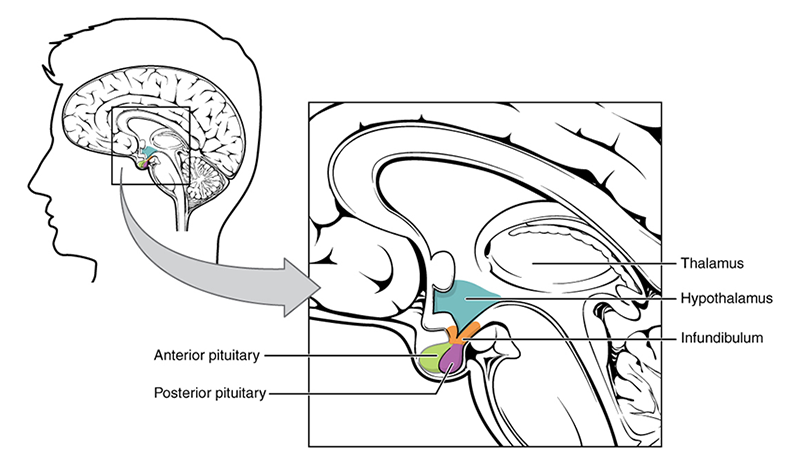
OpenStax College. (2013). Hipotálamo [ilustración]. Tomada de http://commons.wikimedia.org/wiki/File:1806_The_Hypothalamus-Pituitary_Complex.jpg
Existen varios estudios que han demostrado que el aumento de NPY lleva a una mayor sensación de hambre y, con ello, a la hiperfagia que, a largo plazo, conduciría a la obesidad.
Existe una relación lógica entre la leptina y las hormonas tiroideas tiroxina (T4) y triyodotironina (T3); la leptina aumenta la actividad del sistema nervioso simpático; en el tejido adiposo y el músculo, produce un aumento de la termogénesis. Por su parte, las hormonas tiroideas constituyen un factor principal en la regulación del metabolismo basal, la termogénesis y la actividad del simpático.
Tanto las hormonas tiroideas como la leptina aumentan la actividad de las proteínas disociadoras de las mitocondrias (mitochondrial uncoupling protein [UCP2]) y, con ello, favorecen la termogénesis. Es probable que las hormonas tiroideas puedan tener un papel en la regulación y producción de leptina por los adipocitos, posiblemente inhibiendo sus niveles.
La leptina puede inhibir directamente la producción de glucocorticoides en las suprarrenales y, dado que los corticoides producen un efecto directo sobre las células del núcleo paraventricular, reduciendo los niveles de la hormona tiroidea (TRH, por sus siglas en inglés), el aumento de los niveles de leptina puede aumentar, de forma indirecta, la actividad tiroidea.
Parece que, en los estados de ayuno, lo que interesa es el ahorro de energía y, por ello, el aumento de cortisol y la disminución de la leptina producirían una disminución de los niveles de TRH, tanto por acción directa del cortisol a nivel central como por el aumento del NPY hipotalámico.
Por el contrario, en un estado de abundancia calórica, al aumentar los niveles de leptina y disminuir los de cortisol, se produciría un aumento de la termogénesis y del metabolismo basal, tanto por acción de la leptina y hormonas tiroideas sobre las UCP como por la disminución del NPY hipotalámico.
Los estudios efectuados por la Asociación para el Estudio del Genoma (GWA, por sus siglas en inglés) han permitido identificar regiones del genoma humano relacionadas con formas comunes de obesidad, las cuales se definen por medidas antropométricas, tales como IMC, WC o circunferencia de la cintura (waist circumference) y WHR o índice de cadera-cintura (waist-to hip ratio).

Mediante estos estudios, se han detectado más de 50 loci asociados con la obesidad. El primer gen identificado de la obesidad común, de tipo no sindrómico, es el gen FTO (fat mass and obesity associated), que se localiza en el cromosoma 16, como resultado de un estudio de la diabetes tipo 2 (T2D).

Localización del gen FTO (fat mass and obesity associated) en el cromosoma 16
Lo interesante de este hallazgo es que el gen FTO cifra la enzima desmetilasa del ácido nucleico (DNMT, DNA methyltransferase), dependiente de 2-oxoglutarato, que se relaciona con la regulación de la ingesta de alimentos; además, se encontró que el gen FTO está relacionado en una disminución del efecto lipolítico en los adipocitos. También se estableció una fuerte asociación entre la obesidad y los polimorfismos de un solo nucleótido SNP (single nucleotide polimorfisms), localizados cerca del gen para el receptor de la hormona melanocortina 4, relacionada con el apetito (MC4R) y el índice IMC.
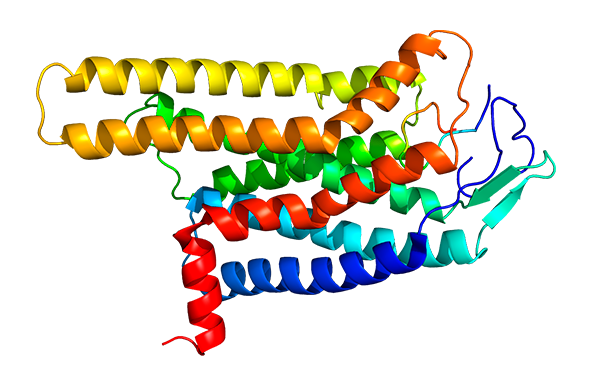
(s. a.) (2011). Estructura de la proteína receptora MC4R [ilustración]. Tomada de http://commons.wikimedia.org/wiki/File:Protein_MC4R_PDB_2IQP.png#mediaviewer/File:Protein_MC4R_PDB_2IQP.png
Por otra parte, se ha asociado una variante de riesgo con la ingestión de lípidos y un aumento del índice IMC en niños, lo cual es consistente con el comienzo de la obesidad causada por mutaciones en el gen MC4R; además, varios genes de regiones asociadas a la obesidad han sido detectados y se expresan en forma elevada en el sistema nervioso central (SNC), lo que sugiere que, en las formas monogénicas poco comunes de obesidad, el papel de las vías del SNC está relacionado sobre todo a una predisposición a la obesidad.
Desde un punto de vista clínico, la obesidad central está asociada con la susceptibilidad a la T2D, a las enfermedades cardiovasculares y a un aumento en la mortalidad. Las pruebas indican que la variabilidad individual en los patrones de distribución de la grasa se relaciona a los procesos del depósito local y forma del cuerpo, los cuales son probablemente independientes de los mecanismos que controlan todo el balance energético y la obesidad en general.

Por medio de estudios sobre WC y WHR, se han identificado 17 nuevos sitios que son comunes a la obesidad central. Curiosamente, algunos de estos sitios muestran una estrecha correlación con los efectos específicos al sexo femenino, ya que el alelo WHR se halla asociado con un aumento de WC en 14 mujeres, pero únicamente en seis hombres.
Esta evidente heterogeneidad entre hombres y mujeres es un reflejo de los efectos genéticos específicos al sexo en los patrones individuales de los depósitos de grasa.
Debido a que varios genes marcados o “troquelados” son factores de crecimiento o reguladores de la expresión genética que lo controlan, a menudo, las alteraciones en el troquelado incluyen la obesidad como una de las características clínicas. El troquelado genético determina la expresión de los genes alelos de acuerdo a su origen materno o paterno y establece un balance entre la expresión de éstos, dando como resultado una serie de efectos negativos en el crecimiento, la diferenciación, el desarrollo, la viabilidad y las funciones metabólicas. Se conocen dos grupos importantes (clusters) de troquelados genómicos en los humanos:
Los errores en el troquelado, que pueden resultar en obesidad, al alterar los factores del crecimiento y la diferenciación celular, pueden deberse a los siguientes eventos genéticos:

Por ejemplo, la disomía uniparental en el cromosoma 15q11-q13 resulta en el síndrome de Prader-Willi, que se caracteriza por comienzo severo de obesidad, a veces con riesgo de la vida, causado por hiperfagia, debido a una disfunción del centro de la saciedad.
Los factores genéticos y epigenéticos se hallan íntimamente ligados, ya que las marcas epigenéticas y las modificaciones del ADN son consecuencia directa de las interacciones entre las proteínas y el ADN.
La presente epidemia de obesidad no es totalmente de origen genético per se, sino también como consecuencia a los cambios desfavorables en el estilo de vida y al ambiente de tipo “obesogénico”, el cual tiene diferentes efectos sobre los individuos que viven en el mismo entorno, ya que heredaron una susceptibilidad a la obesidad y al tipo de distribución del tejido graso.
Lo anterior se hace patente, ya que estos efectos actúan a través del SNC, lo que sugiere que la respuesta del individuo al ambiente obesogénico es parcialmente debida a un aspecto conductual.
En 10 años, una persona normal consume, en promedio, alrededor de 10 millones de calorías, pero su peso solamente sube o baja alrededor de cinco kilos; es decir, en la mayoría de los casos, nuestro peso permanece estable por mucho tiempo. Lo anterior se debe a que nuestro balance calórico funciona como si fuese un termostato que mantiene la temperatura de una habitación en forma estable; sin embargo, nuestros genes y el ambiente afectan el ajuste del “termostato para el peso corporal” y causan un desbalance calórico; por ejemplo, nuestros genes pueden afectar la preferencia por la cantidad y tipos de alimentos; por otra parte, el ambiente afecta la disponibilidad y los alimentos que podamos comer; o sea, que la mayor parte del tiempo el apetito está controlado por factores innatos y resulta incorrecto decir que la obesidad sea debida únicamente a una falta de carácter o decisión propia.
También estos genes pueden afectar nuestra conducta, inclinándonos hacia un tipo de vida que favorezca el riesgo de ser obeso; por ejemplo, algunos genes pueden controlar el apetito; otros nos hacen más sensibles al sabor, al olor y a la apariencia del platillo, con una preferencia por la comida grasosa y evitando el alimento saludable.
Ahora, los alimentos son más apetecibles, están más disponibles en diversas formas y relativamente más baratos, en particular los de tipo procesado; por conveniencia, la gente consume más alimentos preparados, “comida chatarra” y bebidas azucaradas, que son más altos en calorías, grasa, sal y azúcar.
Además de lo anterior, estamos llevando una vida con menor actividad, ya que empleamos el automóvil y el transporte público en mayor grado, antes que andar en bicicleta o caminar, y permanecemos muchas horas trabajando sentados frente al escritorio o viendo la televisión. Si evitamos estos malos hábitos, reduciremos los riesgos de cáncer, males cardiacos, diabetes y muchas otras enfermedades.

(s. a.) (2012). Un joven obeso trabajando con su computadora [fotografía]. Tomada de https://commons.wikimedia.org/wiki/File:Computadoras_y_Obesidad.jpg#/media/File:Computadoras_y_Obesidad.jpg
No obstante, la gente con genes relacionados con la obesidad no está destinada a ser obesa, pero sí tiene un alto riesgo; por tanto, en el mundo moderno, se requiere hacer un mayor esfuerzo para mantener un peso corporal sano a largo plazo, manteniendo los cambios necesarios para una vida plena.
Los cambios epigenéticos prenatales debidos al estrés materno, su comportamiento y su dieta, pueden más tarde predisponer a la descendencia a un persistente trastorno de ansiedad. Estos problemas de ansiedad pueden precipitar la aparición de la obesidad, los cuales persisten, incluso, después de la recuperación de los problemas alimentarios. El individuo obeso es más propenso a padecer serios problemas de salud, entre los que se incluyen:
A pesar de tanta investigación exhaustiva y los esfuerzos actuales para reducir la obesidad mediante dieta, ejercicio, educación, cirugía y terapias con medicamentos, no se ha logrado la solución efectiva a largo plazo de esta epidemia. La meta de la investigación sobre obesidad es la de elucidar las vías y mecanismos que la controlan y mejorar la prevención, el tratamiento y la terapia.
La Organización para la Cooperación y el Desarrollo Económico (OCDE) es una organización de cooperación internacional compuesta por 34 Estados, cuyo objetivo es coordinar sus políticas económicas y sociales.
El tratamiento de la obesidad debe tener, como uno de sus objetivos, mantener un buen estado de salud del paciente, lo que se logra adoptando un estilo de vida saludable, modificando la dieta y hábitos, como la práctica de algún deporte y un tratamiento dietético equilibrado, de acuerdo a los gustos y preferencias individuales. Casi nadie toma en cuenta que los hábitos saludables, como hacer ejercicio y comer bien, son benéficos para nuestro organismo y, particularmente, efectivos.
Actualmente, se están desarrollando programas en varias partes del mundo, encaminados al mejoramiento de la salud de las nuevas generaciones de niños con hábitos más sanos en su dieta y actividades físicas, además de un cambio en los alimentos y bebidas que se expenden en las escuelas, con alto contenido en calorías, grasa y sodio, por fruta y vegetales frescos, cereales y bebidas saludables.
La farmacoterapia enfocada al mejoramiento del bienestar humano es parte de las estrategias dirigidas a reducir la carga que la obesidad y sus consecuencias provocan en el individuo.
Las terapias dirigidas a disminuir el peso corporal tienen una historia de graves riesgos, como las de tipo cardiovascular y psiquiátrico. Un avance en este sentido ha sido el tratamiento de la obesidad crónica creado por la farmacéutica Vivus, Qsymia (hecho con fentermina y topiramato), y la del laboratorio Arena, la lorcaserina, que son los primeros agentes aprobados en los últimos 10 años para el manejo de pacientes obesos.
Además, dentro del uso de los medicamentos empleados para la pérdida de peso, se puede citar el orlistat, que es un inhibidor de la absorción intestinal, aprobado por la Administración de Alimentos y Medicamentos (FDA, por sus siglas en inglés), como una terapia adicional para el tratamiento de la obesidad crónica. Para determinados pacientes, se emplean algunos antidepresivos, como la fluoxetina (Prozac).
En el tratamiento farmacológico, se hace necesaria la participación de un médico, ya que los fármacos siempre tienen algunos efectos colaterales y necesitan ser evaluados previamente para ver si el paciente está en condiciones de recibirlos.
Un enfoque fundamental en el diseño de drogas contra la obesidad consiste en estudiar los circuitos endocrinos que regulan la homeostasis energética, muchos de los cuales son circuitos anorexigénicos. El sistema ARC (análisis y restauración corporal) está constituido por las neuronas que expresan los neurotransmisores, que son clave en la estimulación del apetito: péptido relacionado con el gen de la agutirregulina (AgRP, por sus siglas en inglés) orexigénico y el NPY, además de los anorexigénicos que suprimen el apetito, como la proopiomelanocortina (POMC) y el transcripto cocaína-anfetamina (CART, por sus siglas en inglés).
La modulación de los monoaminoneurotransmisores, tales como la dopamina, la norepinefrina y la serotonina, pueden ser muy efectivos para suprimir el apetito; sin embargo, sus efectos adversos, como los trastornos cardiovasculares y la adicción, constituyen una de las principales preocupaciones para su uso en el tratamiento del exceso de peso corporal.
Por su parte, la compañía Orexigen Therapeutics ha desarrollado la combinación de la droga bupropión, un inhibidor de la dopamina y la norepinefrina, con la naltrexona, un antagonista del receptor a opioides.
La amilina, también conocida como polipéptido amiloideo (IAPP, por sus siglas en inglés) es sintetizada por las células β-pancreáticas y actúa por sinergia con la insulina, regulando los niveles de la glucosa plasmática; también funciona como anoréxica, participando en la supresión del apetito, por vía activación de los receptores de la amilina.
Los nucleótidos cíclicos, como el GMPc (3’-5’-monofosfato de guanosina cíclico) y el AMPc (3’-5’-monofosfato de adenosina cíclico) son “segundos mensajeros”, importantes en varios procesos biológicos. En particular, el papel del GMPc en la regulación del balance calórico es esencial en la biogénesis mitocondrial y la protección al daño oxidativo.
Las técnicas quirúrgicas empleadas para pacientes con obesidad mórbida incluyen la cirugía bariátrica, que reduce el tamaño del estómago y que aumenta la sensación de estar satisfecho y disminuye la ingestión de comida. Los diferentes tipos de cirugía bariátrica incluyen:
Por supuesto que el buen éxito en el tratamiento de la obesidad requiere la constancia y el compromiso del paciente e, igualmente, contar con un entorno estimulante y de apoyo.
La obesidad es producto de diversos mecanismos que incluyen tanto factores genéticos como epigenéticos. Su investigación ha permitido encontrar diversos tratamientos farmacológicos que buscan regular este estado y, en algunos casos, revertirlo.
La obesidad es una enfermedad producto de diversos mecanismos tanto genéticos como epigenéticos. En este contexto, la identificación correcta de estos elementos te llevará a la comprensión de la importancia de la genética y la epigenética en el desarrollo de ésta, así como en la relevancia de los factores ambientales como la ingesta calórica y el tratamiento tanto nutricional como farmacológico de la misma.
Fuentes de información
Chen, H., Charlat, O., Tartaglia, L. A., Woolf, E. A., Weng, X., Ellis, S. J., Lakey, N. D., Culpepper, J., Moore, K. J., Breitbart, R. E., Duyk, G. M., Tepper, R. I. y Morgenstern, J. P. (1996, 9 de febrero). Evidence that the diabetes gene encodes the leptin receptor: identification of a mutation in the leptin receptor gene in db/db mice. Cell, 84(3), 491-495.
Enriori, P. J., Evans, A. E., Sinnayah, P., Jobst, E. E., Tonelli-Lemos, L., Billes, S. K., Glavas, M. M., Grayson, B. E., Perello, M., Nillni, E. A., Grove, K. L. y Cowley, M. A. (2007, marzo). Diet-induced obesity causes severe but reversible leptin resistance in arcuate melanocortin neurons. Cell Metabolism, 5(3), 181-194.
Gerken, T., Girard, C. A., Tung, Y. C., Webby, C. J., Saudek, V., Hewitson, K. S., Yeo, G. S., McDonough, M. A., Cunliffe, S., McNeill, L. A., Galvanovskis, J., Rorsman, P., Robins, P., Prieur, X., Coll, A. P., Ma, M., Jovanovic, Z., Farooqi, I. S., Sedgwick, B., …Schofield, C. J. (2007, 30 de noviembre). The obesity-associated FTO gene encodes a 2-oxoglutarate-dependent nucleic acid demethylase. Science, 318(5855), 1469-1472.
Herrera, B. M., Keildson, S. y Lindgren, C. M. (2011, mayo). Genetics and epigenetics of obesity. Maturitas, 69(1), 41-49.
Huszar, D., Lynch, C. A., Fairchild-Huntress, V., Dunmore, J. H., Fang, Q., Berkemeier, L. R., Gu, W., Kesterson, R. A., Boston, B. A., Cone, R. D., Smith, F. J., Campfield, L. A., Burn, P. y Lee, F. (1977, enero). Targeted disruption of the melanocortin-4 receptor results in obesity in mice. Cell, 88(1), 131-141.
Katsuki, A., Sumida, Y., Gabazza, E. C., Murashima, S., Tanaka, T., Furuta, M., Araki-Sasaki, R., Hori, Y., Nakatani, K., Yano, Y. y Adachi, Y. (2001, mayo). Plasma levels of agouti-related protein are increased in obese men. The Journal of Clinical Endocrinology and Metabolism, 86(5), 1921-1924.
Kaushik, S., Rodríguez-Navarro, J. A., Arias, E., Kiffin, R., Sahu, S., Schwartz, G. J., Cuervo, A. M. y Singh, R. (2011, 3 de agosto). Autophagy in hypothalamic AgRP neurons regulates food intake and energy balance. Cell Metabolism, 14(2), 173-183.
Monda, K. L., Chen, G. K., Taylor, K. C., Palmer, C., Edwards, T. L., Lange, L. A., Ng, M. C., Adeyemo, A. A., Allison, M. A., Bielak, L. F., Chen, G., Graff, M., Irvin, M. R., Rhie, S. K., Li, G., Liu, Y., Liu, Y., Lu, Y., Nalls, M. A., … Haiman, C. A. (2013, junio). A meta-analysis identifies new loci associated with body mass index in individuals of African ancestry. Nature Genetics, 45(6), 690-696.
Müller, T. D., Tschöp, M. H. y Hofmann, S. (2013, enero). Emerging function of fat mass and obesity-associated protein (Fto). PLOS Genetics, 9(1), e1003223.
Ollmann, M. M., Wilson, B. D., Yang, Y. K., Kerns, J. A., Chen, Y., Gantz, I. y Barsh, G. S. (1997, octubre). Antagonism of central melanocortin receptors in vitro and in vivo by agouti-related protein. Science, 278(5335), 135-138.
Ondarza, R. N. (2012). Epigenética, la otra cara de la genética. En J. Guevara, D. Matuz y H. Vázquez (Eds.). Mensaje bioquímico (vol. XXXVI) (pp. 200-211). Departamento de Bioquímica-Facultad de Medicina-Universidad Nacional Autónoma de México.
Rebello, C., Greenway, F. L. y Dhurandhar, N. V. (2014, noviembre). Functional foods to promote weight loss and satiety. Current Opinion in Clinical Nutrition and Metabolic Care, 17(6), 596-604.
Vink, T., Hinney, A., Van Elburg, A. A., Van Goozen, S. H., Sandkuijl, L. A., Sinke, R. J., Herpertz-Dahlmann, B. M., Hebebrand, J., Remschmidt, H., Van Engeland, H. y Adan, R. A. (2001, mayo). Association between an agouti-related protein gene polymorphism and anorexia nervosa. Molecular Psychiatry, 6(3), 325-328.
Xiao, E., Xia-Zhang, L., Vulliémoz, N., Ferin, M. y Wardlaw, S. (2003, mayo). Agouti-related protein stimulates the hypothalamic-pituitary-adrenal (HPA) axis and enhances the HPA response to interleukin-1 in the primate. Endocrinology, 144(5), 1736-1741.
Cómo citar
Trejo, C. R. (2024). Origen epigenético de la obesidad. Unidades de Apoyo para el Aprendizaje. CUAED/Facultad de Medicina-UNAM. [Vínculo].