¿Habías escuchado alguna vez el término de neurocristopatías?
Las neurocristopatías son un grupo de enfermedades causadas por alteraciones que se originan durante el desarrollo embrionario de las células de la cresta neural (CCN). La identificación y comprensión del desarrollo de las CCN ha avanzado en años recientes y el número y variedad de las neurocristopatías ha aumentado tanto, que incluyen a más de 50 enfermedades.
¿Cómo podemos identificar a las neurocristopatías?
Las neurocristopatías son variadas; se han descrito alteraciones craneofaciales, endocrinas, inmunológicas, cardiacas, gastrointestinales, dermatológicas y condiciones neoplásicas.
Estas alteraciones son causadas por fallas en la inducción, migración, proliferación o diferenciación de las CCN, que, a menudo, involucran múltiples órganos o sistemas y pueden ser heredadas.
¿Cuáles son sus manifestaciones clínicas?
Se observan diferentes signos si afectan a varias estructuras, como en los síndromes; asimismo, pueden alterar un tipo celular, como en el albinismo generalizado.

Manifestaciones clínicas de las neurocristopatías
Como verás, es un tema muy interesante, sobre todo, si deseas identificar el origen embrionario de diversas enfermedades que parecerían no estar relacionadas; por ello, te invitamos a revisar el contenido de esta unidad.
Hace 151 años, se describieron las CCN por Wilhelm His (Etchevers et ál., 2019).

Wikimedia Commons. (2015). Wilhelm His [fotografía]. Tomada de https://bit.ly/3h12PQx
Las CCN son inducidas durante la embriogénesis de los vertebrados en el borde de la placa neural, entre el epitelio neural y no neural; se transforman de epitelio a mesénquima, por lo que les llaman ectomesénquima y se pueden diferenciar en células y tejidos de tipo mesodérmico o endodérmico.
Las CCN migran y se distribuyen desde la parte dorsal a la ventral del embrión y a lo largo del neuroeje, donde reciben señales recíprocas para seguir rutas por diferentes regiones: craneal, circunfaríngea y del tronco. Debido a su multipotencialidad se desarrollan en diversas células y tejidos a lo largo de todo el embrión (Snider y Mishina, 2014).
A continuación, se muestra una línea de tiempo en la que se exponen los eventos clave dentro de la investigación de las CCN.
His, 1868
Se describieron las células de la cresta neural en embriones.
Platt, 1893, 1897
Evidencias de la existencia y funciones del mesoectodermo en anfibios.
Hörstadius, 1950
Exploración experimental de múltiples linajes de las crestas neurales en anfibios.
Desarrollo del sistema de marcaje codorniz-pollo para establecer un mapa de destino de las crestas neurales de las aves (Le Douarin 1969, 1973; Le Douarin y Le Lièvre, 1970; Teillet y Le Douarin, 1970; Le Douarin et ál., 1972; Le Douarin y Teillet, 1973, 1974; Le Lièvre y Le Douarin, 1973, 1975; Noden, 1978).
Bolande, 1974
Introducción del concepto de neurocristopatías.
Células de la cresta neural aisladas muestran multipotencialidad en vivo (Bronner y Fraser, 1988).
Evidencia de células troncales de la cresta neural en aves y mamíferos in vitro (Baroffio et ál., 1988, 1991; Stemple y Anderson, 1992; Morrison et ál., 1999, Trentin et ál., 2004; Kleber et ál., 2005).
Demostración de que se pueden heredar mutaciones que dan origen a neurocristopatías humanas (Gibel y Spritz, 1991; Puffenberger et ál., 1994; Hosoda et ál., 1994; Edery et ál., 1996; Hofstra et ál., 1996).
Mapeo de los tres linajes celulares que forman el cráneo de aves, incluyendo las crestas neurales (Couly et ál., 1993).
Primer seguimiento del linaje de las crestas neurales de ratón, mediante herramientas de mapeo de destino genético (Wht1-Cre) (Jiang et ál., 2000; Char et ál., 2000).
Los nervios periféricos son nichos embrionarios y posnatales para células de Schwann y progenitores de células de la cresta neural multipotente (Adameyko et ál., 2009).
Estudio en vivo de la multipotencialidad de las células de la cresta neural del tronco en ratón (Baggiolini et ál., 2015).
Por otro lado, Robert P. Bolande (1974) describió un grupo de enfermedades que parecían no relacionadas, pero que tienen a las CCN como un origen común.
Después de 151 años de la identificación de los múltiples derivados de las CCN por regiones y por migraciones en diferentes momentos y la participación de varios genes, se han logrado explicar las asociaciones clínicas de los síntomas que antes no se comprendían. El concepto de neurocristopatías se introdujo en 1974.
Las alteraciones en la forma, la función o en la apoptosis de las CCN pueden manifestarse en una gran variedad de enfermedades que pueden estar acompañadas por alteraciones del sistema nervioso central (SNC) (The Treacher Collins Syndrome Collaborative Group et ál., 1996; Ten Donkelaar et ál., 2014).
Ahora vamos a revisar las principales neurocristopatías, considerando la región o regiones del tubo neural donde se originan en el desarrollo embrionario; se mencionarán las aportaciones más importantes del desarrollo normal y, posteriormente, las principales manifestaciones clínicas y los genes afectados.
El aspecto más sorprendente de las células migratorias de la cresta neural cefálica es la aparente separación por región frontonasal, primero; luego, segundo y tercer arcos faríngeos, lo que es un proceso muy conservado en los vertebrados.
Las CCN generan el andamio donde se construye la cabeza, huesos y cartílagos en la misma cabeza y cuello, así como tejido conectivo; son, en gran parte, responsables de la forma de la cara y sus variaciones. También forman células pigmentarias y el sistema nervioso periférico. Los defectos congénitos craneofaciales se reconocen como alteraciones en estructuras óseas del cráneo, cara, ojo, oído y dientes, así como en los pares craneales mixtos que se forman a partir de las crestas neurales (Trainor, 2010).

Derivados de la cresta neural craneal
Las CCN cardiacas, un subgrupo de células de la región craneal, principalmente contribuyen al tracto de salida del corazón. Los defectos de la región circunfaríngea pueden afectar a la inervación vagal, así como en cardiopatías relacionadas con el septo aórtico pulmonar, las válvulas cardiacas y glándulas como el timo y la paratiroides.
En la siguiente figura, se muestra un esquema del tubo neural de un embrión de pollo de 33 horas de incubación que correspondería a finales de la tercera semana del desarrollo en el humano. El color rojo corresponde a la cresta neural a nivel del mesencéfalo y de R1 a R8 al del rombencéfalo. Las somitas de color gris se consideran la región circunfaríngea de la cresta neural craneal.
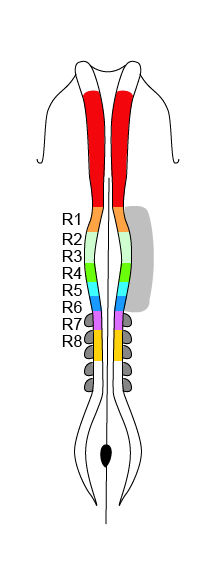
Tubo neural de un embrión de pollo
Las CCN del tronco incluyen las que forman células pigmentarias, algunas del sistema nervioso periférico y las endocrinas de la glándula adrenal. Los principales derivados afectados de las CCN del tronco son la inervación sensitiva y autónoma y la médula suprarrenal (Xi y Lui, 2020). Las CCN entéricas forman el sistema nervioso periférico entérico.
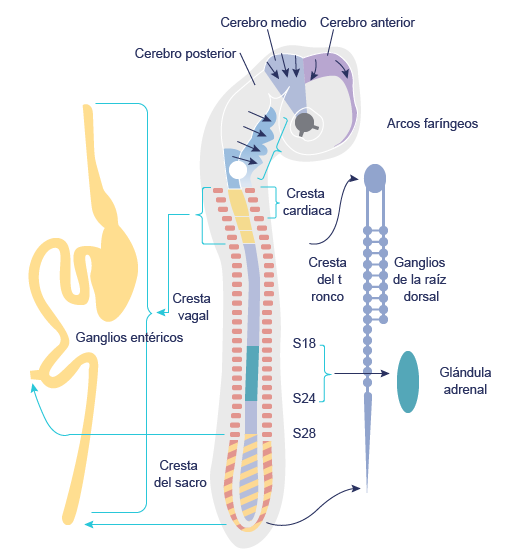
(s. a.) (2022).Embrión de pollo de 56 horas de incubación donde se observan las crestas neurales del tronco [ilustración]. Basada en Gilbert, S. F. (2007). Biología del desarrollo, p. 459.
Aquí, podrás ver las principales neurocristopatías divididas de acuerdo con su origen en las regiones del tubo neural (Carlson, 2020).
Defectos en la migración o en la morfogénesis
Los defectos de diferenciación que afectan a las CCN son el albinismo (mutación puntual). En el siguiente diagrama, se muestran las neurocristopatías que afectan a una o varias regiones del tubo neural.
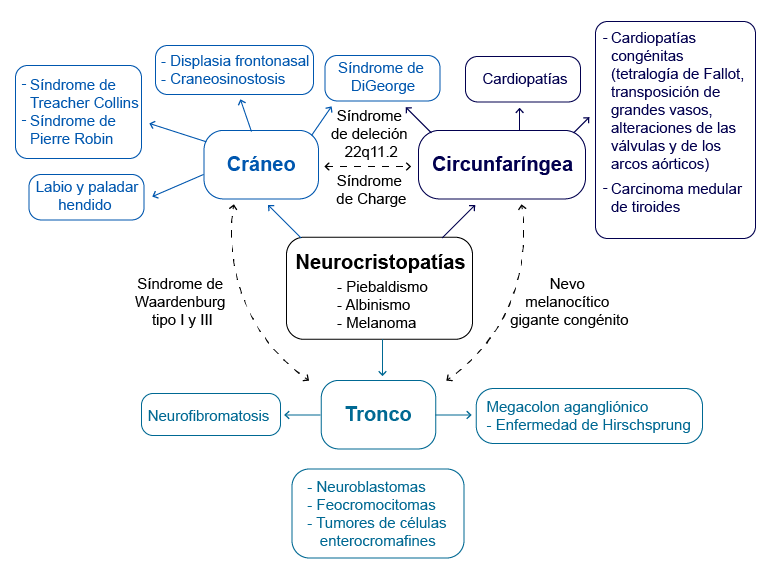
Neurocristopatías
Ahora, revisaremos las manifestaciones clínicas de cada una de estas neurocristopatías.
Alteraciones craneofaciales
Éstas se presentan en la etapa embrionaria por la ausencia de la migración de la vía craneal, así como por las interacciones entre epitelio y mesénquima, provocando fallas en el desarrollo por la falta de fusión de los procesos faciales.
Las malformaciones craneofaciales se encuentran entre las alteraciones más comunes de los recién nacidos, asociadas a defectos en el tracto de salida del tronco cardiaco y a alteraciones que ocasionan una gran variedad de síndromes.
La fisura labiopalatina y el labio hendido son de las neurocristopatías congénitas más frecuentes de la región facial. La incidencia de estos defectos varía según los factores geográficos, la raza y el nivel socioeconómico, con un promedio de uno de cada 700 recién nacidos. Los niños que nacen con hendiduras orofaciales sufren graves problemas de alimentación, dificultades del habla, frecuentes infecciones del oído medio y defectos dentales.
Los tratamientos multidisciplinarios a largo plazo para estas afecciones representan una pesada carga médica, psicológica, social y económica para los pacientes con alteraciones craneofaciales y sus familias (Ji et ál., 2020).
Otras alteraciones son síndromes que se han descrito con severas afectaciones durante su diferenciación en esta región oromandibular, como el de Pierre Robin y el de Crouzon.
La mesénquima proveniente de las CCN de los primordios faciales, durante su desarrollo embrionario, está cubierta por epitelio del ectodermo y contiene un centro de mesodermo paraxial. Estas células se coordinan para dar forma a los patrones y la diferenciación craneofacial del esqueleto y los músculos. Las alteraciones en estas interacciones pueden ser la causa de estas malformaciones.
Aunque las CCN generan muchos tipos celulares distintos, sólo existen de manera transitoria durante el desarrollo embrionario, por lo que es crucial que el embrión produzca y mantenga suficientes para migrar y diferenciarse en el complejo craneofacial (Trainor, 2010).
Las alteraciones en la formación, migración, proliferación o la sobrevivencia que provoca una disminución del número celular modifican su destino final, ocasionando anomalías craneofaciales sindrómicas o no sindrómicas (Ji et ál., 2020). A continuación, revisaremos otras anomalías que se presentan en el cráneo.
Las displasias frontonasales son resultado de alteraciones en el número de CCN en las prominencias faciales en desarrollo y el primer arco faríngeo, en muchos casos relacionado con un aumento de la apoptosis de las CCN, muchas de ellas por mutaciones en una variedad de genes diferentes.
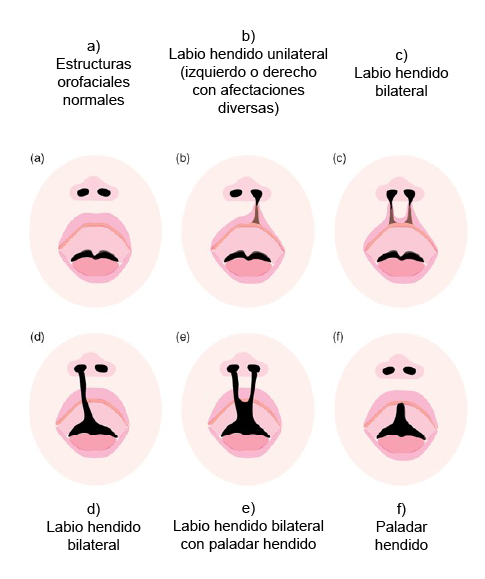
(s. a.) (2022). Principales tipos de hendiduras orofaciales en humanos [ilustración]. Basada en Ji, Y., Garland, M. A., Sun, B., Zhang, S., Reynolds, K., McMahon, M., Rajakumar, R., Islam, M. S., Liu, Y., Chen, Y. y Zhou, C. J. (2020). “Cellular and developmental basis of orofacial clefts”, p. 2.
Aunque el ectodermo de superficie y el endodermo faríngeo tienen importantes funciones de señalización en el patrón de la región craneofacial en formación, son las CCN craneales las que forman la mayor parte del hueso y cartílago dentro de la cabeza, los dientes y los ganglios craneales. Las CCN rostrales hacen grandes contribuciones al esqueleto frontonasal y el viscerocráneo, mientras que las CCN craneales más caudales migran hacia los arcos faríngeos donde forman la mandíbula y el maxilar, el oído medio y el hueso hioides.
Estudios en modelos animales, particularmente en ratones y pollos, han resaltado la importancia de las cascadas de señalización específicas, incluido el homólogo sonic hedgehog (SHH, por sus siglas en inglés), el factor de crecimiento de fibroblastos (FGF, por sus siglas en inglés) y las vías de las proteínas morfogenéticas óseas (BMP, por sus siglas en inglés), en el desarrollo de la región craneofacial (Phillips et ál., 2012).

(s. a.) (2022). Displasia frontonasal [ilustración]. Basada en Carlson, B. (2020). Embriología humana y biología del desarrollo, pp. 254-268.
Los menores que poseen este síndrome presentan características faciales unilaterales o bilaterales, hipoplasia de la glándula paratiroides, aplasia del párpado inferior, fisuras palpebrales cortas, así como hipertelorismo, coloboma, macrostomía en un 15 %, paladar hendido en un 33 %, anomalías dentales, hipoplasia de la faringe, atresia de coanas y fístula traqueoesofágica.
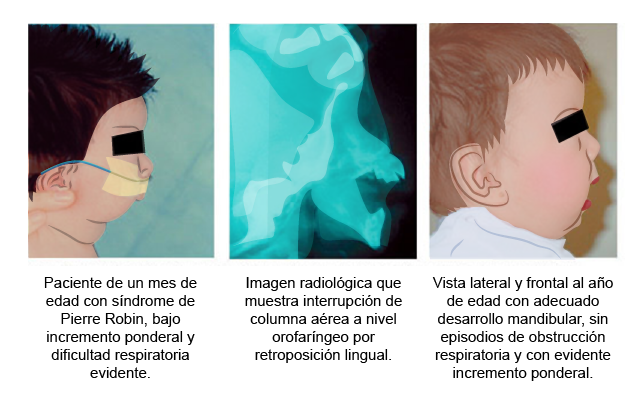
(s. a.) (2022). Síndrome de Pierre Robin [ilustración]. Basada en Morovic, C. G. (2004). “Manejo actual en síndrome de Pierre Robin”, p. 39.
El síndrome de Crouzon, también llamado disostosis craneofacial, fue descrito por primera vez por un cirujano francés, Louis Édouard Octave Crouzon, en 1912, como una malformación craneofacial asociada al cierre prematuro de las suturas craneanas. Debido a esto, se produce un acortamiento del cráneo y abombamiento en su parte anterior, lo cual también afecta a la relación entre los dientes.
La causa de este síndrome es el cambio genético o mutación en los genes receptores del factor de crecimiento del fibroblasto (FGFR, por sus siglas en inglés) y el FGFR2 en el cromosoma 10. Se le considera una enfermedad hereditaria autosómica dominante.

Síndrome de Crouzon
Este síndrome fue descrito en 1900 y, clínicamente, presenta hipoplasia de los huesos faciales, paladar hendido, alteraciones del oído medio y externo y defectos en el desarrollo del cerebro. Se caracteriza por ser una condición rara que afecta a 1 : 50 000 nacidos vivos, consecuencia de la insuficiente proliferación de las CCN destinadas a la cabeza.
¿Qué es?
Es una alteración con varias anomalías craneofaciales, así como del oído medio y externo que pueden provocar pérdida de la audición. Se hereda de manera autosómica recesiva y se origina por problemas en la fusión de las prominencias faciales o los procesos palatinos, ambos derivados de las CCN.
La mayoría de los casos de Treacher Collins pueden atribuirse a la mutación del gen TCOF1 del cromosoma 5; este gen es importante para la formación, la proliferación y la sobrevivencia de las CCN porque la proteína ayuda en la biogénesis y maduración de los ribosomas, en la síntesis de proteínas. En las fallas de la expresión de TCOF1, se reduce el número de CCN durante el cierre del tubo neural debido a una disminución de la proliferación y un aumento en la apoptosis dependiente de p53 dentro del epitelio de la cresta neural, lo que disminuye la reserva de progenitores de las CCN, que migran a los arcos faríngeos para formar una adecuada arquitectura craneofacial.
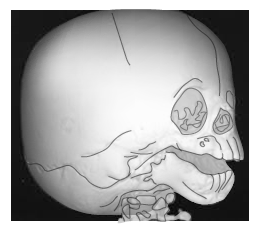
Síndrome de Treacher Collins
¿Cómo se manifiesta?
En la siguiente figura, se puede ver a dos pacientes hermanos con el síndrome de Treacher Collins, que afecta estructuras craneofaciales derivadas de las CCN (A, B, F y G); presentan hendiduras orbitales oblicuas (flechas verdes), micrognatia (flechas rojas), hendiduras del arco cigomático (flechas azules), deficiencia de los tejidos blandos faciales, microtia y atresia del canal auditivo (A-E). Las imágenes F y G demuestran la variabilidad fenotípica del síndrome en la hermana de A; se notan los tejidos blandos faciales menos dañados y afectación del oído medio y la oreja. La microsomía craneofacial (H) es una condición esporádica que afecta los mismos derivados de la cresta neural, pero que usualmente se presenta de manera asimétrica (Trainor, 2014).
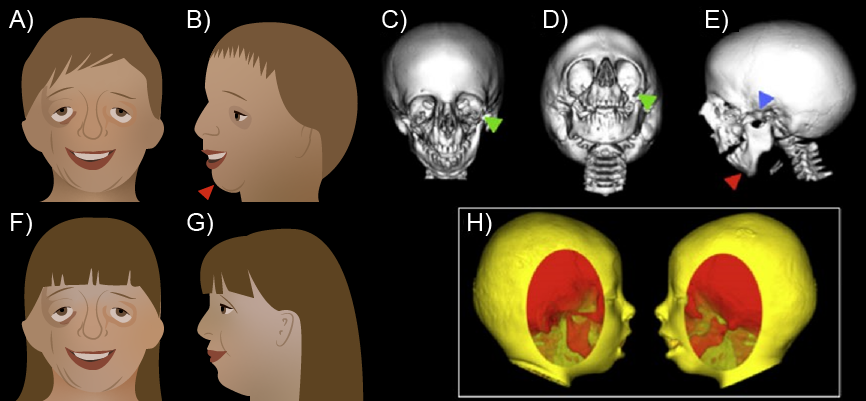
(s. a.) (2022). Células de la cresta neural: evolución, desarrollo y enfermedad [ilustración]. Basada en Trainor, P. A. (2014). Neural crest cells. Evolution, development and disease, p. 451.
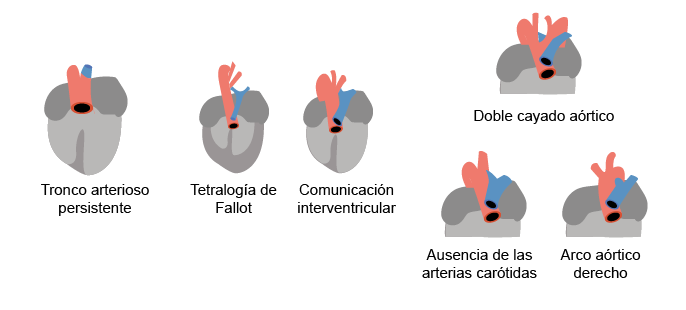
La falla en la migración de las CCN produce fenotipos cardiacos alterados (Carlson, 2020), como la persistencia del tronco arterioso, la doble salida ventricular derecha, los defectos septales interventriculares y la malformación de los componentes valvulares aórtico y pulmonar.
Un ejemplo de los defectos septales es la estenosis aórtica/pulmonar, como la tetralogía de Fallot, que se caracteriza por:
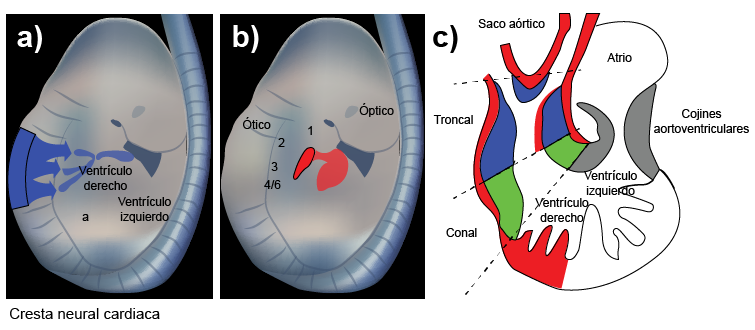
(s. a.) (2022). Anomalías del tracto cardiaco [ilustración]. Basada en https://pubmed.ncbi.nlm.nih.gov/24014420/#&gid=article-figures&pid=figure-2-uid-1
En la siguiente figura, se puede ver el tubo neural de un embrión de pollo de 33 horas de incubación. Se distinguen las regiones del desarrollo de las CCN; en color morado y azul, se marca la región de donde migran las CCN cardiacas.
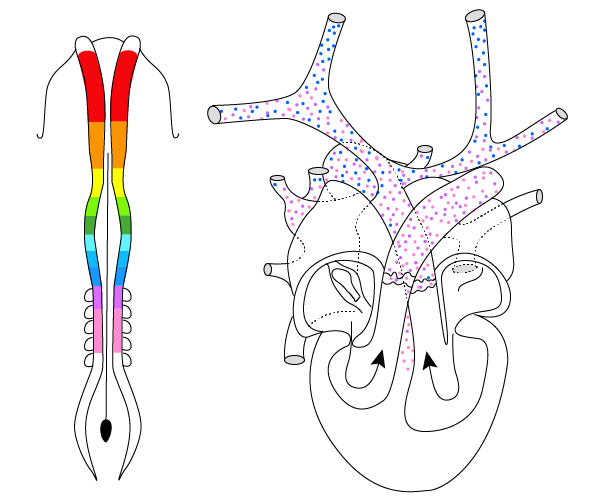
Origen embrionario del tracto de salida del corazón
Por otra parte, en la siguiente figura, podemos ver el desarrollo del corazón. Las grandes arterias son la aorta (en rojo) y la arteria pulmonar (en azul), que se forman a partir de la cresta neural cardiaca.
(s. a.) (2022). Desarrollo del corazón [ilustración]. Basada en Hutson, M. R. y Kirby, M. L. (2003). “Neural crest and cardiovascular development: a 20-year perspective”, p. 3.
Síndrome de DiGeorge (neurocristopatía de la región craneal y circunfaríngea)
A este síndrome también se le conoce Catch 22 y microdeleción 22q11.2.
La deformidad de la microsomía hemifacial varía en su extensión y gravedad; pueden estar afectadas todas las estructuras derivadas del primer y segundo arcos faríngeos.

Síndrome de DiGeorge
Básicamente, este síndrome se manifiesta clínicamente por hipoplasia auricular, maxilar y mandibular; estas malformaciones pueden ser bilaterales, aunque son más frecuentes las unilaterales, deleciones o hipoplasias del tercer arco al manifestar hipoparatiroidismo, deficiencia tiroidea y displasia tímica; produce inmunodeficiencia, malformaciones de los cartílagos y músculos laríngeos, defectos en el infundíbulo de salida cardiaco y en los arcos aórticos; por lo tanto, es un defecto de las crestas neurales craneales y cardiacas; puede ser resultado de la síntesis de ácido retinoico.

(s. a.) (2022). Síndrome de DiGeorge [infografía]. Basada en Ten Donkelaar, H. J., Vermeij-Keers, C. y Mathijssen, I. M. J. (2014). Clinical neuroembryology, pp. 219-269.
Charge se definió como un acrónimo en inglés de los defectos en individuos con:
Charge es una enfermedad autosómica dominante que afecta 1 : 10 000 nacimientos. Alrededor del 65 % de los casos son el resultado de mutaciones en CDH7, un gen remodelador de cromatina dependiente de trifosfato de adenosina (ATP, por sus siglas en inglés) y se identificó como una molécula reguladora de formación y función de las CCN. Los genes que son influenciados por CHD7 incluyen TWIST, SLUG Y SOX9, todos necesarios para la migración de las CCN. La mayoría de las mutaciones del gen CHD7 produce una proteína anormal que se rompe prematuramente. Se piensa que la poca duración de esta proteína provoca que se altere la remodelación de la cromatina; por lo tanto, la regulación de la expresión génica. Estos cambios en la expresión génica durante el desarrollo embrionario probablemente sean la causa de los signos y síntomas del síndrome de Charge (Carlson, 2020; Cabrejas et ál., 2014).
El síndrome de Charge se caracteriza por la asociación de malformaciones orgánicas y deficiencias neurosensoriales (visión, audición, olfato y equilibrio). Su acrónimo no contempla otras cuatro manifestaciones que son más específicas:
El número de anomalías y su gravedad es muy variable de un paciente a otro. A menudo, son visibles desde el nacimiento, aunque en ocasiones se detectan de forma más tardía (formas moderadas) (Enciclopedia Orphanet, s. f.).
Otras alteraciones no tan comunes del síndrome de Charge que se pueden presentar son el retraso del desarrollo y labio o paladar hendido. Los individuos afectados frecuentemente tienen hipogonadismo hipogonadotrópico que afecta la producción de hormonas y, a su vez, el desarrollo sexual. Como resultado, los varones tienen micropenes y falla en el descenso de los testículos (criptorquidia) (Carlson, 2020; Cabrejas et ál., 2014).
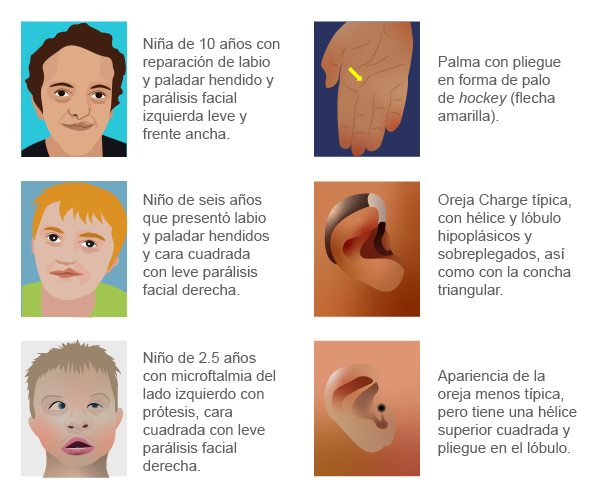
(s. a.) (2022). Síndrome de Charge [ilustración]. Basada en Hsu, P., Ma, A., Wilson, M., Williams, G., Curotta, J., Munns, C. F. y Mehr, S. (2014). “CHARGE syndrome: a review”, p. 507.
Síndrome de Waardenburg
El síndrome de Waardenburg se hereda de manera autosómica dominante y afecta a 1 : 42 000 nacimientos. Hay seis genes relacionados con el síndrome: PAX3, MITF, endotelina 3 (END3), ENDRB, SOX10 y SNAI2. La proteína PAX3 especifica tempranamente las crestas neurales; sus mutaciones provocan apoptosis de las futuras CCN.

Síndrome de Waardenburg
Sus características incluyen sordera, constipación, albinismo parcial, distopia canthorum (desplazamiento lateral del canto) y, en algunos casos, defectos del septo auricular y espina bífida. Los pacientes se clasifican en tipos I, II, III o IV; dependiendo de las características que presente, este síndrome cursa con combinaciones diversas de defectos en la pigmentación, en general una banda blanca en el cabello y otras alteraciones pigmentarias de la piel, además de sordera, paladar hendido e hipertelorismo (incremento del espacio entre los ojos). PAX3 se expresa también en las CCN cardiacas en migración, pero está inhibido en las células que colonizan las paredes del infundíbulo de salida del corazón o los arcos aórticos. En estas áreas, también se observan defectos cardiovasculares en las personas con mutaciones en PAX3 (Carlson, 2020).

Niño y niña con síndrome de Waardenburg tipo I con heterocromía del iris
¿Qué es la enfermedad de Hirschsprung (megacolon agangliónico)?
Otra de las neurocristopatías es la enfermedad de Hirschsprung; es un defecto del sistema nervioso entérico como una consecuencia de la falla en la migración, proliferación y diferenciación de CCN de la región sacrococcígea provocada por numerosas alteraciones genéticas; esta alteración se puede presentar sola y se denomina “enfermedad de Hirschsprung aislada” o puede asociarse con otros signos y síntomas, por lo que tiene un tipo de herencia multifactorial, ya que interactúan múltiples genes con factores ambientales, lo que constituye un síndrome. Se caracteriza por la ausencia de neuronas entéricas en el sistema nervioso entérico debido a la incapacidad de las CCN para migrar a alguna o varias partes del intestino distal. La enfermedad de Hirschsprung se asocia con otros síndromes.
En la siguiente figura, se puede ver un colon por enema (radiografía en proyección lateral que muestra zona de transición entre el recto agangliónico y el sigmoides normogangliónico).
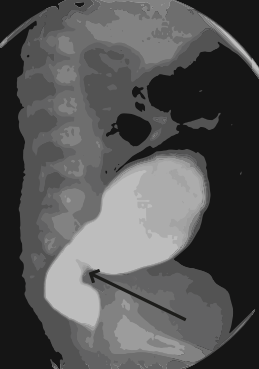
(s. a.) (2022). Colon con enfermedad de Hirschsprung [ilustración]. Basada en Santos-Jasso, K. (2017). “Enfermedad de Hirschsprung”, p. 75.
¿Cómo se manifiesta?
Se caracteriza por una obstrucción en el tracto intestinal. Estas alteraciones se deben a la falta de la llegada de los ganglios y nervios al intestino, que se encargan de las contracciones musculares que mueven las heces a través del intestino; la ausencia de estos nervios resulta en estreñimiento severo u obstrucción completa del intestino (compactación); el segmento intestinal afectado que no tiene la inervación necesaria se denomina segmento aganglionar o agangliónico.
Signos y síntomas
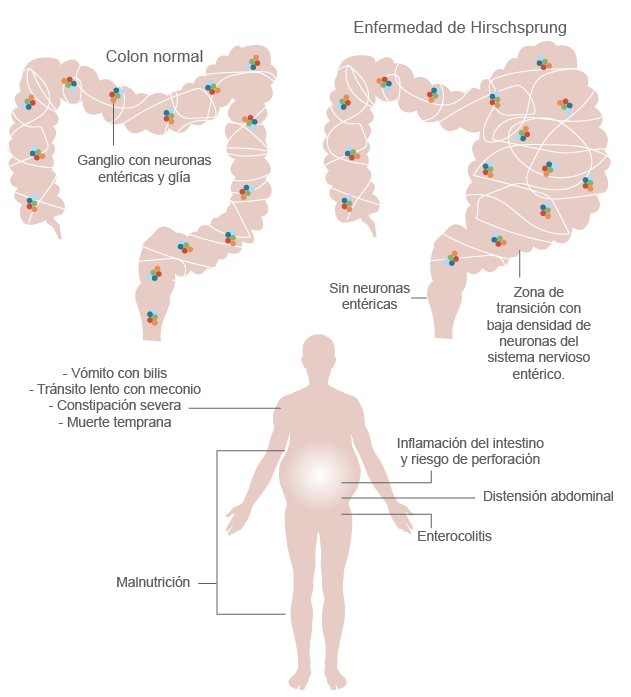
(s. a.) (2022). Enfermedad de Hirschsprung [ilustración]. Basada en Santos-Jasso, K. (2017). “Enfermedad de Hirschsprung”, p. 75.
La gran capacidad de las CCN para migrar y diferenciarse parece hacerlas más susceptibles a volver a sus derivados para transformarse en tumores, por lo que las CCN dan lugar a muchos diferentes linajes tumorales que surgen de sus diversas regiones.
Neuropatías
Dentro de las neurocristopatías, se encuentran los tumores de estirpe neuronal (neuroblastoma, ganglioneuroblastoma, ganglioneuroma, neurofibroma), tumores del sistema de captación y descarboxilación de los precursores de las aminas (APUD, por sus siglas en inglés) o sistema neuroendocrino (feocromocitoma, paragangliomas, carcinoma medular de tiroides, tumor carcinoide), defectos neurosensoriales, entre otros.
Son tumores comunes en la infancia por pronóstico diverso; se originan de las CCN simpatoadrenales que no se lograron diferenciar. Los síntomas se presentan por la compresión de estructuras adyacentes o por síndromes paraneoplásicos. A continuación, revisaremos en qué consiste cada tumor:
Es un tumor neoplásico de los más comunes extracraneales de la infancia; al año, representa el 15 % de todas las muertes de cáncer. El neuroblastoma se caracteriza clínicamente por la presencia de una masa palpable de tumores torácicos.
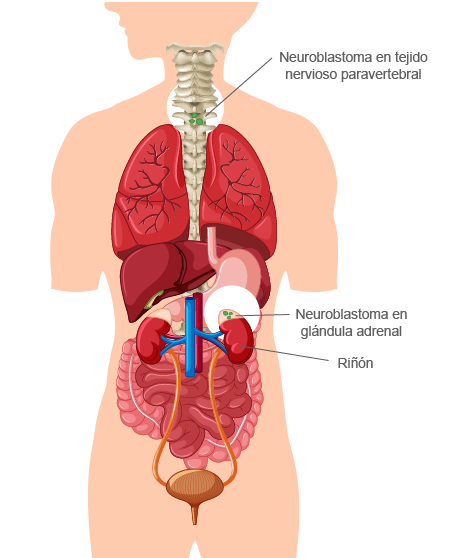
Neuroblastomas
Estos tumores están muy vascularizados y surgen de ganglios autónomos o de las células cromafines de la glándula adrenal. Normalmente, secretan catecolaminas que conducen a taquicardia e hipertensión y aumentan el riesgo de infarto; pueden comprimir estructuras cercanas.
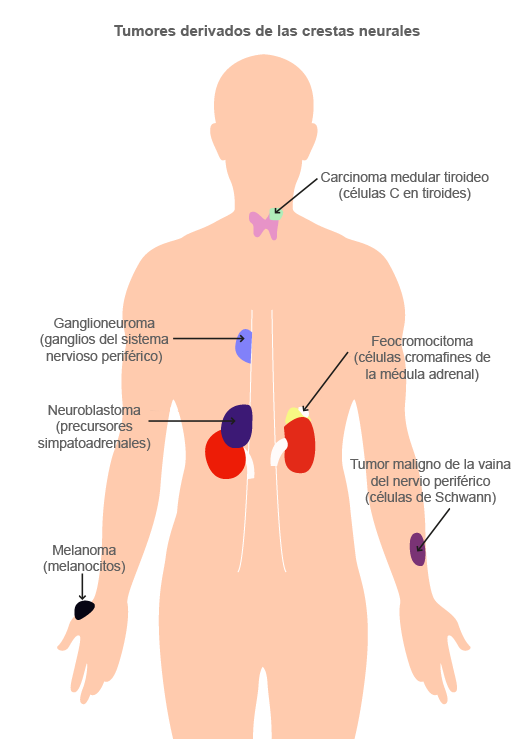
(s. a.) (2022). Tumores derivados de las crestas neurales [ilustración]. Basada en Maguire, L. H., Thomas, A. R. y Goldstein, A. M. (2014). “Tumors of the neural crest: common themes in development and cancer”, p. 312.
Son tumores derivados de las CCN. El linaje de las CCN es extremadamente diverso y ampliamente distribuido. Los diferentes tipos van desde carcinoma tiroideo medular de las células C hasta feocromocitoma de las células cromafines de la médula adrenal.
De estos tumores, existen diferentes tipos; por ejemplo, nevus pigmentados múltiples congénitos y tumores melanocíticos del SNC; son el tumor más común de las CCN; el melanoma tiene una gran variedad de factores de riesgo y tiende a hacer metástasis de forma agresiva, lo cual puede deberse a la expresión en los melanocitos de factores de transición epitelio-mesénquima que se activan durante el desarrollo embrionario de las CCN. Los genes PAX3, SOX10, END3 y su receptor ENDRB, c-kit y MITF juegan un papel crítico en el desarrollo de los melanocitos.
Los melanocitos derivados de la cresta neural migran hacia la piel donde sintetizan melanina en los melanosomas. Como parte de algunas de estas alteraciones, se han podido identificar modificaciones en líneas celulares que dan como resultado algunos cánceres, como los melanomas (tumores melanocíticos) (Bertolotto, 2013).
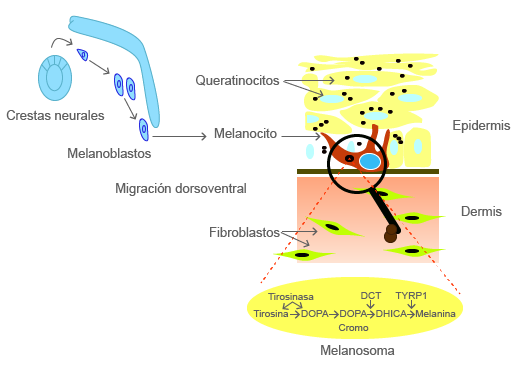
(s. a.) (2022). Melanoma [ilustración]. Basada en Bertolotto, C. (2013). “Melanoma: from melanocyte to genetic alterations and clinical options”, p. 2.
Los melanocitos se derivan de las células de la cresta neural como precursores indiferenciados sin pigmento; los melanoblastos migran hasta la epidermis donde sintetizan melanina en los melanosomas.
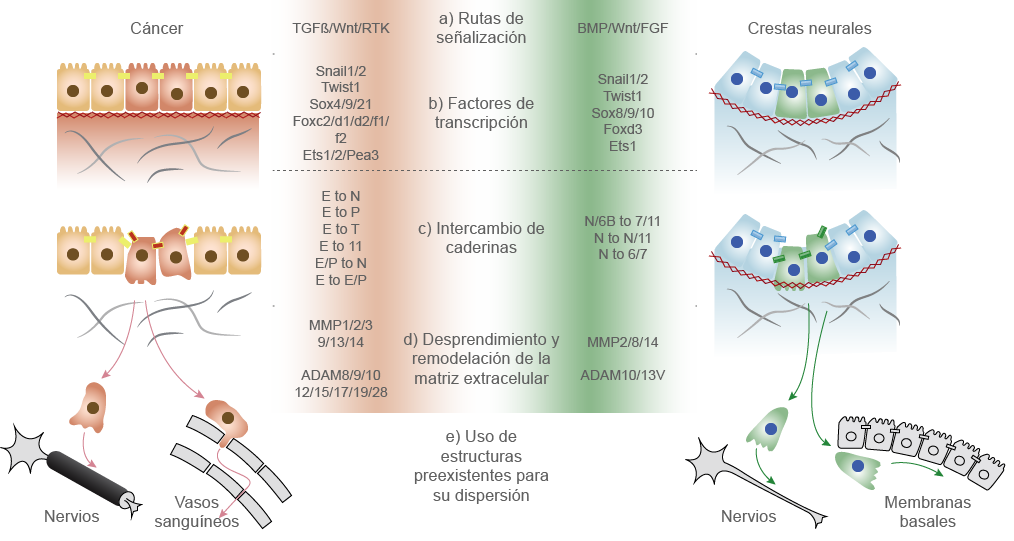
(s. a.) (2022). La metástasis del cáncer [ilustración]. Basada en Theveneau, E. y Mayor, R. (2012). “Neural crest delamination and migration: from epithelium-to-mesenchyme transition to collective cell migration”, p. 49.
La metástasis del cáncer y la migración de las CCN tienen muchas similitudes:
Son tumores de los nervios periféricos y son un grupo de enfermedades genéticas multisistémicas. Las neurofibromatosis tipo I y II involucran las células de Schwann. Su tipo de herencia es autosómica dominante o por mutaciones espontáneas.
Un síntoma de la neurofibromatosis tipo I es la aparición de manchas de color café en la piel. Estas manchas son conocidas como “manchas de café con leche”.
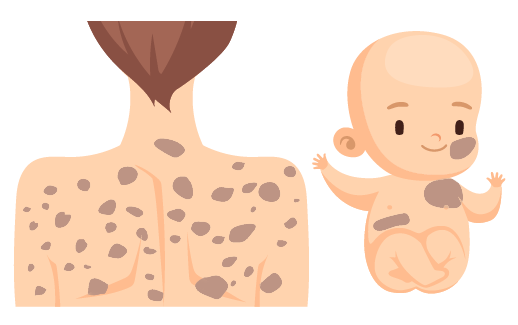
Neurofibromatosis
A continuación puedes ver la secuencia para los criterios para el diagnóstico de la neurofibromatosis tipo I; se confirma si se cumplen dos o más (Suárez et ál., 2001).

Suárez, R., Trasobares, L., Medina, S. y García, M. (2001). Criterios para el diagnóstico de neurofibromatosis tipo I [tabla]. Tomada de Suárez, R., Trasobares, L., Medina, S. y García, M. (2001). “Formación continuada del médico práctico. Neurofibromatosis”, p. 65.
Cánceres de linajes múltiples
Las neoplasias endocrinas múltiples se heredan de manera autosómica dominante; se caracterizan por mutaciones del gen RET, que ayuda en la migración y colonización de las CCN en el intestino anterior. El gen MEN2A se asocia con el cáncer de la médula de tiroides y feocromocitomas. Otros ejemplos son:
Se debe a la falta de migración o reducción en la población de los melanocitos, lo que genera su ausencia en frente, tórax, abdomen y extremidades; también puede encontrarse como manchas blancas en pelo, cejas y pestañas. El albinismo se caracteriza por máculas blanquecinas irregulares en la piel (máculas pigmentadas); presenta herencia autosómica dominante. Al respecto, están involucradas mutaciones del dominio intracelular de la enzima tirosina-cinasa.
Recientemente, se ha identificado una mutación en el gen KIT, localizada en el locus del cromosoma 4q12; de este gen, que codifica para la tirosina-cinasa, se han descrito más de 40 mutaciones diferentes (heterogeneidad alélica) en fenotipos más severos.

(s. a.) (2022). Albinismo [ilustración]. Basada en http://dx.doi.org/10.5070/D314k128r2
Se caracteriza por la ausencia o disminución (hipopigmentación) de pigmentación en piel, ojos y pelo, así como por nistagmo, agudeza visual reducida y fotofobia; afecta a uno de cada 20 000 personas, en todas las razas por igual sin distinción de sexo; en el albinismo, hay un defecto en el gen que se encarga de la síntesis y distribución de la melanina.
Es causado por mutaciones en varios genes que controlan la síntesis de melanina en los melanocitos. Las variantes OCA1A, OCA1B, OCA-MP y OCA-TS están causadas por mutaciones en el gen TYR, que llevan una pérdida total o parcial de la actividad catalítica de la tirosina-cinasa.

Ali, B. (2018). Albinismo [fotografía]. Tomada de https://bit.ly/3ztROwB
En esta unidad, se han descrito las neurocristopatías más caracterizadas, de acuerdo con la región del embrión donde se originan y con sus diversos grados de afectación. Este conocimiento será útil para el entendimiento, el tratamiento, la prevención y orientación de las malformaciones congénitas humanas relacionadas con las crestas neurales.
Como has visto, las neurocristopatías tienen un origen embrionario según la región del tubo neural.
Identificar el origen embrionario de las neurocristopatías es importante, ya que te ayudará a reconocer las diferentes manifestaciones clínicas que presentan las personas.
Fuentes de información
Bibliografía
Bolande, R. P. (1974, julio). The neurocristopathies: a unifying concept of disease arising in neural crest maldevelopment. Human Pathology, 5(4), 409-426.
Bronner-Fraser, M. y Fraser, S. E. (1988). Application of new technologies to studies of neural crest migration and differentiation. American Journal of Medical Genetics, 4, 23-39.
Carlson, B. (2020). Embriología humana y biología del desarrollo (6.a ed.). Elsevier.
Gilbert, S. F. (2007). Biología del desarrollo (7.a ed.). Médica Panamericana.
His, W. (1868). Untersuchungen über die erste Anlage des Wirbelthierleibes: die erste Entwickelung des Hühnchens im Ei. Vogel.
Stemple, D. L. y Anderson, D. J. (1992, diciembre). Isolation of a stem cell for neurons and glia from the mammalian neural crest. Cell, 71(6), 973-998.
Theveneau, E. y Mayor, R. (2012, junio). Neural crest delamination and migration: from epithelium-to-mesenchyme transition to collective cell migration. Developmental Biology, 366(1), 34-54.
Trainor, P. A. (2014). Neural crest cells. Evolution, development and disease. Academic Press.
Documentos electrónicos
Bertolotto, C. (2013, 12 de diciembre). Melanoma: from melanocyte to genetic alterations and clinical options. Scientifica, 1-23. https://www.hindawi.com/journals/scientifica/2013/635203/
Cabrejas, A., Conchello, R., Roncalés, P., Royo, D. y Rite, S. (2014, diciembre). Síndrome de CHARGE: una nueva mutación en el gen CHD7. Anales de Pedriatría, 81(6), e46-e47. https://www.analesdepediatria.org/es-sindrome-charge-una-nueva-mutacion-articulo-S1695403314000927
Demirci, G. T., Atis, G. y Altunay, I. K. (2011, noviembre). Waardenburg syndrome type 1: a case report. Dermatology Online Journal, 17(11). http://dx.doi.org/10.5070/D314k128r2
Enciclopedia Orphanet. (s. f.). Síndrome CHARGE. https://www.orpha.net/data/patho/Pub/es/SindromeCHARGE_ES_es_PUB_ORPHA138.pdf
Etchevers, H. C., Dupin, E. y Le Douarin, N. M. (2019, 11 de marzo). The diverse neural crest: from embryology to human pathology. Development, 146(5). https://journals.biologists.com/dev/article/146/5/dev169821/48997/The-diverse-neural-crest-from-embryology-to-human
Heuckeroth, R. O. (2018, 4 de enero). Hirschsprung disease-integrating basic science and clinical medicine to improve outcomes. Nature Reviews. Gastroenterology and Hepatology, 15(3), 152-167. https://www.nature.com/articles/nrgastro.2017.149
Hsu, P., Ma, A., Wilson, M., Williams, G., Curotta, J., Munns, C. F. y Mehr, S. (2014, 19 de febrero). CHARGE syndrome: a review. Journal of Paediatrics and Child Health, 50(7), 504-511. https://onlinelibrary.wiley.com/doi/10.1111/jpc.12497
Hutson, M. R. y Kirby, M. L. (2003, febrero). Neural crest and cardiovascular development: a 20-year perspective. Birth Defects Research, Part C. Embryo Today: Reviews, 69(1), 2-13. https://pubmed.ncbi.nlm.nih.gov/12768653/
Ji, Y., Garland, M. A., Sun, B., Zhang, S., Reynolds, K., McMahon, M., Rajakumar, R., Islam, M. S., Liu, Y., Chen, Y. y Zhou, C. J. (2020, noviembre). Cellular and developmental basis of orofacial clefts. Birth Defects Research, 112(19), 1558-1587. https://doi-org.pbidi.unam.mx:2443/10.1002/bdr2.1768
Le Douarin, N. M. y Kalcheim, C. (1999). The neural crest (2.a ed.). Cambridge University Press. https://www.ncbi.nlm.nih.gov/books/NBK6098/
Maguire, L. H., Thomas, A. R. y Goldstein, A. M. (2014, marzo). Tumors of the neural crest: common themes in development and cancer. Developmental Dynamics, 244(3), 311-322. https://anatomypubs.onlinelibrary.wiley.com/doi/full/10.1002/dvdy.24226
Morovic, C. G. (2004, enero). Manejo actual en síndrome de Pierre Robin. Revista Chilena de Pediatría, 75(1), 36-42. https://dx.doi.org/10.4067/S0370-41062004000100005
Neeb, Z., Lajiness, J. D., Bolanis, E. y Conway, S. J. (2013, julio). Cardiac outflow tract anomalies. Wiley Interdisciplinary Reviews: Developmental Biology, 2(4), 499-530. https://pubmed.ncbi.nlm.nih.gov/24014420/
Phillips, H. M., Papoutsi, T., Soenen, H., Ybot-Gonzalez, P., Henderson, D. y Chaudhry, B. (2012, 21 de mayo). Neural crest cell survival is dependent on Rho kinase and is required for development of the mid face in mouse embryos. PLOS ONE, 7(5). https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0037685
Santos-Jasso, K. (2017, enero-febrero). Enfermedad de Hirschsprung. Acta Pediátrica de México, 38(1), 72-78. http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S0186-23912017000100072
Snider, T. N. y Mishina, Y. (2014, septiembre). Cranial neural crest cell contribution to craniofacial formation, pathology, and future directions in tissue engineering. Birth Defects Research, Part C. Embryo Today: Reviews, 102(3), 324-332. https://onlinelibrary.wiley.com/doi/full/10.1002/bdrc.21075
Suárez, R., Trasobares, L., Medina, S. y García, M. (2001, junio). Formación continuada del médico práctico. Neurofibromatosis. Medicina Integral, 38(2), 64-68. https://www.elsevier.es/es-revista-medicina-integral-63-pdf-13015324
Ten Donkelaar, H. J., Vermeij-Keers, C. y Mathijssen, I. M. J. (2014). The neural crest and craniofacial malformations. En Clinical neuroembryology (pp. 219-269). Springer. https://link.springer.com/chapter/10.1007/978-3-642-54687-7_5#citeas
Trainor, P. A. (2010, diciembre). Craniofacial birth defects: the role of neural crest cells in the etiology and pathogenesis of Treacher Collins syndrome and the potential for prevention. American Journal of Medical Genetics. Part A, 152A(12), 2984-2994. https://pubmed.ncbi.nlm.nih.gov/20734335/
The Treacher Collins Syndrome Collaborative Group, Dixon, J., Edwards, S. J., Gladwin, A. J., Dixon, M. J., Loftus, S. K., Bonner, C. A., Koprivnikar, K. y Wasmuth, J. J. (1996, 1 de febrero). Positional cloning of a gene involved in the pathogenesis of Treacher Collins syndrome. Nature Genetics, 12(2), 130-136. https://www.nature.com/articles/ng0296-130
Xi, M. y Lui, F. (2021, 26 de julio). Neuroanatomy, neural crest. StatPearls. https://www.ncbi.nlm.nih.gov/books/NBK547700/
Imagen de portada
(s. a.) (2022). CME. The spectrum of orofacial clefting [fotografía]. Basada en https://www.semanticscholar.org/paper/CME-The-Spectrum-of-Orofacial-Clefting-Eppley-Aalst/35f98cc46c77afc2defc9347cb7fdebe02baa890
Cómo citar
Aguirre, E. L., Velázquez, A. y González del Pliego, M. V. (2022). Neurocristopatías. Unidades de Apoyo para el Aprendizaje. CUAIEED/Facultad de Medicina UNAM. (Vínculo)