La enfermedad de Parkinson es un desorden neurodegenerativo complejo que tiene diversos orígenes, desde factores genéticos y ambientales hasta factores epigenéticos, los cuales han demostrado tener participación en el desarrollo de este padecimiento.
En esta unidad, se estudian dichos factores y se destacan principalmente los factores epigenéticos como la metilación del ADN, modificación de histonas y expresión alterada de los microARN, los cuales tienen un efecto importante en este padecimiento. Debido a que la modulación epigenética es responsable de la activación diferencial de diversos genes, su perturbación provocada por factores ambientales puede llevar a un desbalance en la expresión genética, lo cual se traduce en modificaciones que llevan al inicio y desarrollo de enfermedades neurodegenerativas como la enfermedad de Parkinson.
También se abordan diversos tratamientos para esta enfermedad, con base en los mismos factores que la generan.
La enfermedad de Parkinson (PD) fue descrita y documentada en 1817 en el libro Essay on the Shaking Palsy por el médico británico James Parkinson, aunque los cambios bioquímicos asociados fueron identificados en la década de los sesenta.
A principios de ese año, los investigadores describieron un defecto cerebral fundamental que es el distintivo de la enfermedad: las pérdidas de células cerebrales que producen el neurotransmisor dopamina que ayuda a dirigir la actividad muscular. Este descubrimiento contribuyó para encontrar el primer tratamiento eficaz de esta enfermedad y sugirió formas para elaborar nuevas y más eficaces terapias.
Es un padecimiento neurodegenerativo que se produce en el cerebro por la pérdida de neuronas en la sustancia negra cerebral (en latín substantia nigra). Este trastorno suele presentarse en personas de edad avanzada; se caracteriza por la lentitud de los movimientos voluntarios o ausencia, así como rigidez muscular y temblor.
La sustancia nigra o locus niger es una porción heterogénea del cerebro medio. Se conforma por dos ensambles fuertemente contrastados: uno conformado por el pars compacta y los grupos adyacentes dopaminérgicos, y otro integrado por el pars reticulata y el pars lateralis. Estos últimos dos, junto con el globus pallidus y el núcleo palial, son elementos del núcleo del ganglio basal.
La sustancia nigra compacta es la responsable de la producción de dopamina en el cerebro y, por lo tanto, realiza un papel vital.
Se considera que la oxidación por radicales libres ocasiona daño en los tejidos, incluidas las neuronas. Normalmente, los antioxidantes que protegen a las células mantienen bajo control el daño producido por los radicales libres.
Las pruebas de que los mecanismos oxidativos pueden ocasionar o contribuir en el desarrollo de la enfermedad de Parkinson incluyen el hallazgo de que los pacientes presentan niveles elevados de hierro en el cerebro, especialmente en la sustancia nigra, y niveles decrecientes de ferritina,que sirve como mecanismo protector al formar un círculo alrededor del hierro y aislarlo.
Otros estudios han sugerido que la enfermedad de Parkinson puede ocurrir cuando una toxina externa o interna destruye selectivamente las neuronas dopaminérgicas. Un factor de riesgo ambiental, como la exposición a pesticidas o una toxina en el suministro de alimentos, son un ejemplo de la clase de desencadenante externo que hipotéticamente podría ocasionar el padecimiento.
Hay cierto número de toxinas, como la tetrahidropiridina (MPTP) y medicamentos neurolépticos, que inducen síntomas de Parkinson; sin embargo, hasta la fecha, ninguna investigación ha proporcionado pruebas concluyentes de que una toxina sea la causa de la enfermedad.
Otra teoría sugiere el papel de los factores genéticos en el desarrollo de esta enfermedad, ya que de un 15 a un 25 % de los pacientes tiene un familiar cercano que ha experimentado los síntomas.
Por último, otra teoría propone que el padecimiento ocurre cuando, por causas desconocidas, el desgaste de las neuronas productoras de dopamina normal, relacionado con el envejecimiento, se acelera en ciertas personas. Esta teoría se sustenta en el conocimiento de que la pérdida de mecanismos protectores antioxidantes está asociada con la enfermedad de Parkinson.
Muchos investigadores creen que una combinación de los mecanismos siguientes puede finalmente identificarse como causas de la enfermedad:
La ferritina es la principal proteína almacenadora de hierro en los vertebrados. Se encuentra principalmente en el hígado, bazo, mucosa intestinal y médula ósea.
(s. a.) (2006). Ferritina [ilustración]. Tomada de http://commons.wikimedia.org/wiki/File:Ferritin.png#/media/File:Ferritin.png
En 1997, se demostró una mutación en el gen de la alfa-sinucleína (SNCA) asociada con la enfermedad de Parkinson. Se trata de una proteína neuronal presináptica, la cual puede contribuir de diversas formas a la patogénesis.
Sumado a lo anterior, la SNCA secretada puede ejercer efectos dañinos sobre las células circundantes y, como consecuencia, provocar agregación y contribuir a la propagación de la enfermedad. Aunque todavía no se tiene claridad absoluta de hasta dónde se relaciona en todos los casos de la PD, el estudio de estas funciones tóxicas puede conducir a nuevas estrategias tanto en PD como en otras condiciones neurodegenerativas, denominadas sinucleinopatías.
Las más recientes investigaciones apoyan la hipótesis de que en los casos de PD y Alzheimer (AD), las protofibrillas son las especies tóxicas que intervienen en la alteración de la homeostasis celular y muerte neuronal, a través de sus efectos sobre varios blancos intracelulares, incluida la función sináptica. De este modo, un tratamiento enfocado al bloqueo de la formación de las protofibrillas podría ser lo más efectivo para combatirlas.
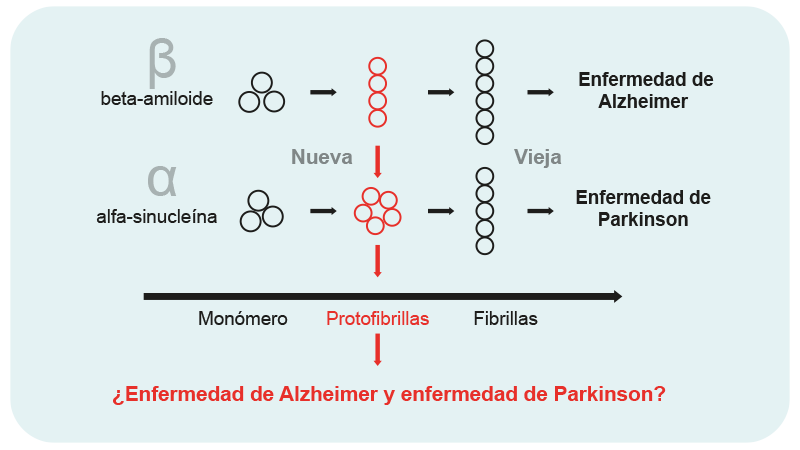
Efecto de las protofibrillas en los casos de Alzheimer y Parkinson
A partir de esto, varios loci del gen PARK1-15 y otros genes han sido relacionados con formas familiares de esta enfermedad. Además, ahora existen suficientes pruebas de que al menos seis genes, como la a-sinucleína, la cinasa 2 rica en leucinas, la parkin, la cinasa 1 (PTEN), la DJ-1 y la ATP13A2, causan formas heredables de PD típicas o síndromes parkinsonianos.
FBXO7 pertenece a la familia de las proteínas F-box; las mutaciones en el gen recesivo FBXO7 también causan una neurodegeneración progresiva en el sistema extrapiramidal y piramidal y se le propone como una nueva entidad genética que forma parte de PARK1-15.
Las proteínas F-box participan en muchos procesos celulares importantes, como la formación de complejos proteínicos, mantenimiento de la estabilidad del genoma, formación de sinapsis y ritmos circadianos.
Otros genes que no están localizados en los loci PARK, como el MAPT, SCA1, SCA2, entre otros, también causan síndromes de parkinsonismo. Sin embargo, estudios recientes realizados mediante una amplia búsqueda del genoma revelan que, en la mayoría de los casos de PD (que son formas idiopáticas esporádicas), hasta 20 genes podrían contribuir al riesgo de padecer la enfermedad.
Desde luego, se debe considerar también el aumento de evidencias que sugieren los mecanismos epigenéticos como la metilación del ADN, las modificaciones de las histonas y los mecanismos mediante el microARN, los cuales pueden regular la expresión de genes relacionados a PD, como podrás revisar en el siguiente apartado.
Los estudios en pacientes dependientes del alcohol o con anorexia revelan una hipermetilación del promotor de la SNCA, lo cual sugiere que el gen podría estar regulado epigenéticamente.
Además, se ha detectado que la metilación del ADN en el intrón de SNCA se halla reducida en varias regiones cerebrales de pacientes esporádicos con PD, incluyendo a la sustancia nigra, putamen y cortex. Dicho de otra forma, existe una regulación epigenética.
Los análisis epigenéticos de cerebros procedentes de pacientes con PD revelan que el gen de la SNCA podría estar sujeto a una regulación epigenética, así como por otros genes relacionados con PD.
El grupo de sinucleínas incluye tres proteínas: alfa-sinucleína, beta-sinucleína y gama-sinucleína. El interés por estudiar estas proteínas se inició cuando la alfa-sinucleína fue identificada como mutante en varias familias con la enfermedad de Parkinson con carácter autosómico dominante.
Tipos de sinucleínas y su participación en la enfermedad de Parkinson
Esta proteína abunda en el cerebro, su función normal consiste en regular las comunicaciones entre neuronas en las sinapsis. Se polimeriza en fibrillas amiloides y forma inclusiones filamentosas intraneuronales características en las enfermedades neurodegenerativas.
Las mutaciones de la alfa-sinucleína se asocian con la aparición temprana de la enfermedad de Parkinson familiar, así como Alzheimer, Lewy y otros padecimientos de tipo neurodegenerativo.
Es una proteína que, en los humanos, está cifrada por el gen SNCB. Ha demostrado estar altamente expresada en la sustancia nigra del cerebro, una región de la degeneración neuronal en los pacientes con enfermedad de Parkinson.
Esta proteína se expresa en tumores mamarios y es una marca de progreso del tumor.
La expresión genética está modulada no sólo por metilación del promotor, sino también por el estado que guarda la cromatina, en su estado condensado inactivo (heterocromatina), o en el no condensado y, por lo tanto, activo (eucromatina).
Además de la acetilación, las modificaciones que sufren las histonas incluyen a la metilacion, fosforilación, ubiquitinación, sumoilación y otras modificaciones postransduccionales.
Aunque se sabe poco sobre las modificaciones de las histonas en cerebros de individuos con PD, existen estudios obtenidos en cultivos celulares y modelos animales con esta enfermedad, inducidos por toxinas de acción mitocondrial como el paraquat y la rotenona, o por los compuestos que tengan un efecto marcado sobre la expresión de la alfa-sinucleína humana.
La PD es causada tanto por factores genéticos como ambientales; un ejemplo de esto son las sirtuinas, que son deacetilasas dependientes de nicotinamida-adenina-nucleótido (NAD) que regulan una variedad de funciones celulares y están involucradas en la enfermedad.
Hay siete sirtuinas en los mamíferos, las cuales se relacionan con la restricción calórica y el envejecimiento, y modulan el metabolismo energético, la estabilidad genómica y la resistencia al estrés. Estas enzimas son agentes potenciales terapéuticos en una variedad de enfermedades humanas que incluyen el cáncer, la diabetes y las alteraciones inflamatorias y neurodegenerativas, ya que modulan los factores de transcripción y desacetilan las especies proteotóxicas.
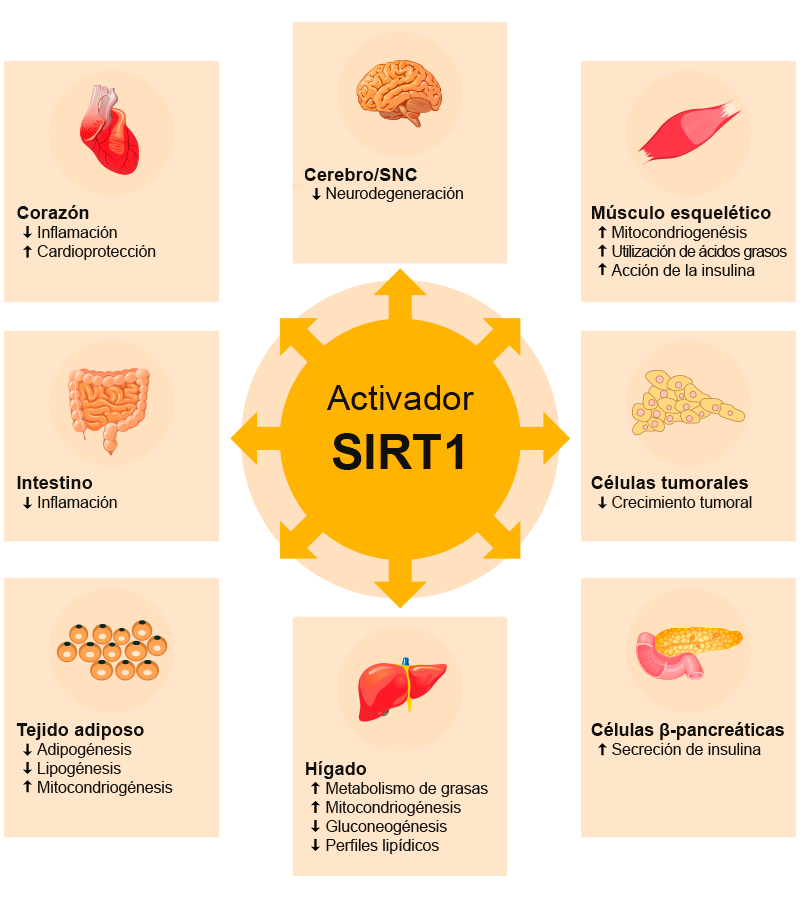
Lavu, S., Boss, O., Elliott, P. y Lambert, P. (2008). Distribución de las sirtuinas en varios órganos del cuerpo humano [ilustración]. Tomada de http://www.nature.com/nrd/journal/v7/n10/full/nrd2665.html
La sirtuina 1 es una enzima multifuncional con actividad específica de desacetilasa para histonas; se encuentra principalmente en el citoplasma.
Los microARN (miARN) son un grupo de ARN pequeños que se unen a regiones 3' que no se traducen en proteínas (3'UTR) e intervienen en la regulación postranscripcional al inhibir según el grado de la secuencia complementaria.
Una investigación realizada por Kim et ál. (2007) aborda el papel que juegan los miARN en las neuronas dopaminérgicas del cerebro medio de los mamíferos, e identifica una expresión deficiente en las neuronas dopaminérgicas de pacientes con PD.
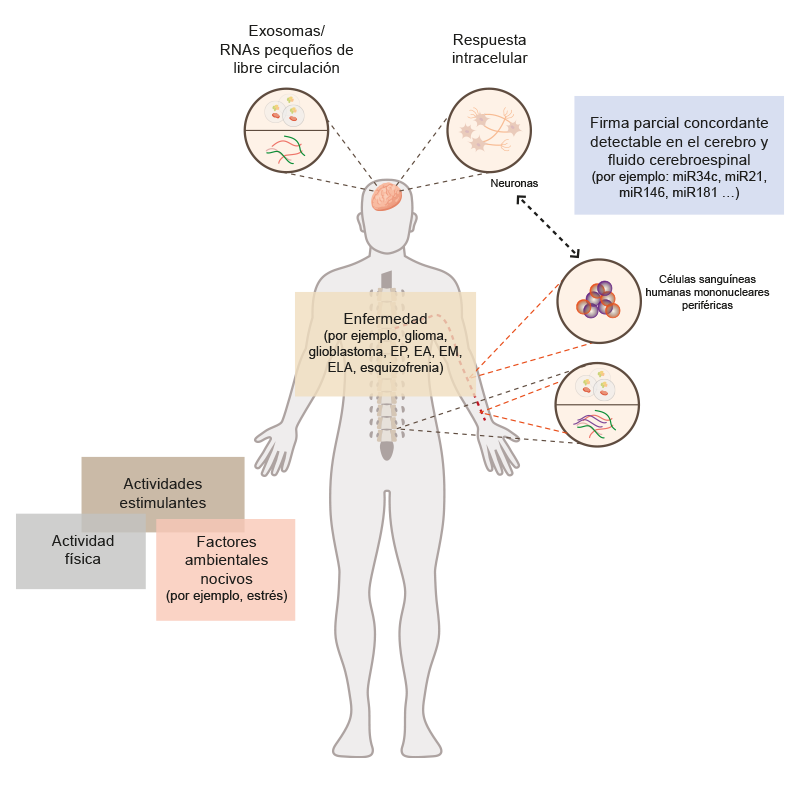
Rao, P., Benito, E. y Fischer, A. (2013). Un modelo para el desarrollo de biomarcadores basados en miARN [ilustración]. Tomada de http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3840814/
En la actualidad, es posible emplear muestras de sangre para demostrar la presencia de miARN asociados a la PD. No obstante, aún hace falta investigar esta enfermedad para comprender las interrelaciones complejas entre los biomarcadores genéticos y epigenéticos, el estilo de vida y los factores ambientales para caracterizar a los individuos con riesgo de desarrollar este padecimiento.
El tratamiento de la enfermedad de Parkinson consiste en mejorar o, en su defecto, mantener o prolongar la funcionalidad del paciente durante el mayor tiempo posible. En la actualidad, existen tres tipos de tratamiento: farmacológico, quirúrgico y rehabilitador. En los casos donde se requiera, es posible combinarlos entre sí.
Muchos síntomas característicos de la enfermedad de Parkinson obedecen a una deficiencia de dopamina en el cerebro, pero el suministro de este neurotransmisor al paciente con el objetivo de reponer las reservas agotadas no resulta eficaz, ya que la dopamina no puede pasar del torrente sanguíneo al cerebro.
En la actualidad, los fármacos más usados son la levodopa y varios agonistas de dopamina, aunque existen otros con cierta relevancia, como la selegilina (inhibidor de la MAO-B), la amantadina (liberador de dopamina) o la benzatropina (antagonista del receptor muscarínico de la acetilcolina).
Tipos de tratamientos farmacológicos
La bromocriptina, un derivado de los alcaloides del claviceps purpurea, es un potente agonista de la dopamina, un inhibidor de la adenohipófisis eficaz en la enfermedad de Parkinson.
Otro agonista dopaminérgico es la lisurida, cuyos efectos adversos son parecidos a los de la bromocriptina. Su administración es parenteral y sólo está aprobada para el tratamiento de la enfermedad de Parkinson en Europa.
La selegilina es un inhibidor selectivo para la MAO-B, que es la predominante en las zonas del sistema nervioso central que tienen dopamina. Con la inhibición de la MAO-B, se consigue proteger a la dopamina de la degradación intrapersonal.
El descubrimiento accidental en 1969 de que la amantadina resultaba beneficiosa en la enfermedad de Parkinson propició que ésta dejase de utilizarse únicamente como un fármaco antiviral, para lo cual se había concebido originalmente.
Posibles mecanismos de acción a partir de pruebas neuroquímicas indican que la amantadina incrementa la liberación de la dopamina, inhibe la recaptación de aminas o ejerce una acción directa sobre los receptores de dopamina. Estudios recientes muestran que inhibe la acción del glutamato cerebral que provoca la generación de radicales libres.
Actualmente se utiliza en conjunto con la levodopa con el fin de logar controlar los trastornos motores, especialmente la discinesia, y prolongar la vida útil de la levodopa.
A mediados del siglo XX, la neurocirugía era el método utilizado con mayor frecuencia para tratar el temblor y la rigidez característica de los pacientes aquejados de la enfermedad de Parkinson. Su problema radicaba en que no siempre se tenía éxito en las intervenciones quirúrgicas y en las complicaciones de gravedad que solían surgir.
Con el avance tecnológico de los últimos años, se han logrado conseguir novedosas técnicas de imagen cerebral que han permitido mejorar la precisión quirúrgica, al recuperar la neurocirugía su popularidad como tratamiento para algunas personas con enfermedad de Parkinson que, por diversos motivos, ya no responden al tratamiento con fármacos.
La cirugía para la EP se puede dividir en dos grandes grupos:
Los ámbitos de actuación de la ECP o lesiones incluyen el tálamo, el globo pálido o el núcleo subtalámico. La ECP es el tratamiento quirúrgico más utilizado; fue desarrollado en la década de los ochenta por Alim-Louis Benabid y otros colaboradores. Consiste en implantar un dispositivo médico denominado marcapaso cerebral, el cual envía impulsos eléctricos a partes específicas del cerebro.
La tACS anula la señal del cerebro que causa los temblores, al aplicar una pequeña corriente eléctrica a través de electrodos en el exterior de la cabeza de un paciente; funciona mediante la colocación de dos almohadillas de electrodos en la cabeza del paciente, por encima de la corteza motora (la parte del cerebro implicada en el control de los temblores).
Trasplante nervioso
En 1982, la enfermedad de Parkinson fue el primer padecimiento de tipo neurodegenerativo para el cual se intentó realizar un trasplante nervioso; este hecho alcanzó una notable repercusión mediática.
Si bien es importante que los pacientes realicen ejercicio de manos, es aún más necesario que un terapeuta del lenguaje trabaje con el paciente el máximo tiempo posible, ya que debe corregir la disfagia, el manejo de objetos, la hipofonía, la ansiedad y demás aspectos del lenguaje.
Si con el tratamiento farmacológico se consigue que los pacientes mejoren en cuanto a los síntomas motores, no sucede lo mismo con el equilibrio, el cual va empeorando conforme la enfermedad avanza.
La enfermedad de Parkinson es una de las enfermedades neurodegenerativas más comunes; se caracteriza por la pérdida crónica y progresiva de las neuronas dopaminérgicas en la substancia nigra pars compacta. Sus causas son el conjunto de diversos mecanismos como las toxinas ambientales, la predisposición genética y epigenética, así como el envejecimiento acelerado.
Por lo tanto, es fundamental para el médico profesionista entender las causas de la enfermedad, ya que su conocimiento ha llevado al desarrollo de diversos tratamientos farmacológicos, quirúrgicos y de rehabilitación para subsanarla.
La enfermedad de Parkinson es producto de diversos mecanismos que incluyen tanto factores genéticos como epigenéticos. Su investigación ha permitido desarrollar diversos tratamientos que buscan revertir los daños ocasionados por la misma.
La enfermedad de Parkinson es producto de diversos mecanismos tanto genéticos, como epigenéticos. En este contexto, la identificación correcta de estos elementos te llevará a la comprensión de la importancia de la genética y la epigenética en el desarrollo de la enfermedad de Parkinson. La siguiente autoevaluación te permitirá reafirmar tus conocimientos sobre el tema.
Fuentes de información
Bibliografía
Bronstein, J. M., Tagliati, M., Alterman, R. L., Lozano, A. M., Volkmann, J., Stefani, A., Horak, F. B., Okun, M. S., Foote, K. D., Krack, P., Pahwa, R., Henderson, J. M., Hariz, M. I., Bakay, R. A., Rezai, A., Marks Jr., W. J., Moro, E., Vitek, J. L., Gross, R. E. y DeLong, M. R. (2011, febrero). Deep brain stimulation for Parkinson disease: an expert consensus and review of key issues. Archives of Neurology, 68(2), 165.
Bruening, W., Giasson, B. I., Klein-Szanto, A. J., Lee, V. M., Trojanowski, J. Q. y Godwin, A. K. (2000, mayo). Synucleins are expressed in the majority of breast and ovarian carcinomas and in preneoplastic lesions of the ovary. Cancer, 88(9), 2154–2163.
Coppedè, F. (2012, mayo). Genetics and Epigenetics of Parkinson's Disease. The Scientific World Journal (2012), 1-12.
Dymek, M., Atchison, P., Harrell, L. y Marson, D. (2000, enero). Competency to consent to medical treatment in cognitively impaired patients with Parkinson’s. Neurology, 56(1), 17-24.
George, J. M. (2002, diciembre). The synucleins. Genome Biology, 3(1), 1-6.
Goedert, M. (2001, julio). Alpha-synuclein and neurodegenerative diseases. Nature. Reviews. Neuroscience, 2(7), 492–501.
Herskovits, A. y Guarente, L. (2013, mayo). Sirtuin deacetylases in neurodegenerative diseases of aging. Cell Research (23), 746-758.
Kim, J., Inoue, K., Ishii, J., Vanti, W. B., Voronov, S. V., Murchison, E., Hannon, G. y Abeliovich, A. (2007, agosto). A MicroRNA feedback circuit in midbrain dopamine neurons. Science, 317(5842), 1220-1224.
Lindvall, O. y Bjorklund, A. (2011, octubre). Cell therapeutics in Parkinson's disease. Neurotherapeutics, 8(4), 539-548.
Polymeropoulos, M. H., Lavedan, C., Leroy, E., Ide, S. E., Dehejia, A., Dutra, A., Pike, B., Root, H., Rubenstein, J., Boyer, R., Stenroos, E. S., Chandrasekharappa, S., Athanassiadou, A., Papapetropoulos, T., Johnson, W. G., Lazzarini, A. M., Duvoisin, R. C., Di Iorio, G., Golbe, L. I. y Nussbaum, R. L. (1997, julio). Mutation in the alpha-synuclein gene identified in families with Parkinson's disease. Science, 276(5321), 2045–2047.
Rao, P., Benito, E. y Fischer, A. (2013, noviembre). MicroRNAs as biomarkers for CNS disease. Frontiers in Molecular Neurosicence, 6(39), 1-13.
Stefanis, L. (2012, febrero). á-Synuclein in Parkinson's Disease. Cold Spring Harb Perspectives in Medicine, 2(2).
Zeng, L., Chen, R., Liang, F., Tsuchiya, H., Murai, H., Nakahashi, T., Iwai, K., Takahashi, T., Kanda, T. y Morimoto, S. (2009, marzo). Silent information regulator, Sirtuin 1, and age-related diseases. Geriatrics and Gerontology International, 9(1), 7-15.
Zhou, Z. D., Sathiyamoorthy, S., Ángeles, D. C. y Tan, E. K., (2016, 18 de abril). Linking F-box protein 7 and parkin to neuronal degeneration in Parkinson’s disease (PD). Molecular Brain, 9(41).
Documentos electrónicos
Lavu, S., Boss, O., Elliott, P. y Lambert, P. (2008, octubre). Sirtuins-novel therapeutic targets to treat age-associated diseases. Nature Reviews Drug Discovery (7), 841-853. http://www.nature.com/nrd/journal/v7/n10/full/nrd2665.html
Cómo citar
Trejo, C. (2023). Origen epigenético del Parkinson. Unidades de Apoyo para el Aprendizaje. CUAED/Facultad de Medicina-UNAM. (Vínculo)