En esta unidad se definirá el proceso celular de la meiosis, sus diferencias con la mitosis, las
aneuploidías más comunes de importancia médica, así como algunos síndromes autosómicos y de
cromosomas sexuales.
La meiosis es un proceso de división celular que caracteriza a las células gonadales masculinas
y femeninas, necesario para la producción de gametos. En este proceso una célula diploide (2n)
entra a dos divisiones sucesivas (meiosis I y meiosis II) para formar cuatro células haploides
(n) en los túbulos seminíferos del testículo, mientras que en el proceso de ovogénesis sólo se
forma una célula haploide (n) en la corteza ovárica por cada célula diploide (2n) que entra en
el proceso de meiosis.
Identificar a la meiosis como un tipo de división celular; analizar sus fases, así como su papel en la variabilidad genética, para entender el origen de anomalías cromosómicas de importancia médica.
La meiosis es un tipo de división celular que consiste en una duplicación del ADN (ácido desoxirribonucleico) seguida por dos divisiones nucleares:
Divisiones celulares en la meiosis
Este tipo de división celular es una característica de las células sexuales que
permite que en el proceso de la fecundación se restablezca la carga genética de la especie
humana, que es de 46 cromosomas (2n).
Las células sexuales son las únicas células programadas genéticamente para dividirse por meiosis
y originar células genética y estructuralmente diferentes a las células progenitoras; sin
embargo, inicialmente estas células se dividen por mitosis para mantener una población constante
de células sexuales. En diferentes momentos del desarrollo, un grupo de células sexuales (antes
del nacimiento en la mujer y en la pubertad en el varón) iniciará un ciclo meiótico, en el que
duplicará su material genético, pasará de 46 cromosomas monovalentes a 46 cromosomas bivalentes,
e iniciará la primera división meiótica (2n, 4c).
Una vez duplicados los cromosomas, la célula entra a la profase I, que está dividida en cinco
subfases.
Para conocer más detalles del proceso de la profase l, revisa la siguiente animación, en la que se detallan más elementos de las subfases.
Profase I
Al terminar la profase I, las células resultantes tienen información genética diferente a la
célula progenitora, a lo que se conoce como variabilidad genética; los cromosomas
duplicados y recombinados se alinean en el ecuador durante la metafase.
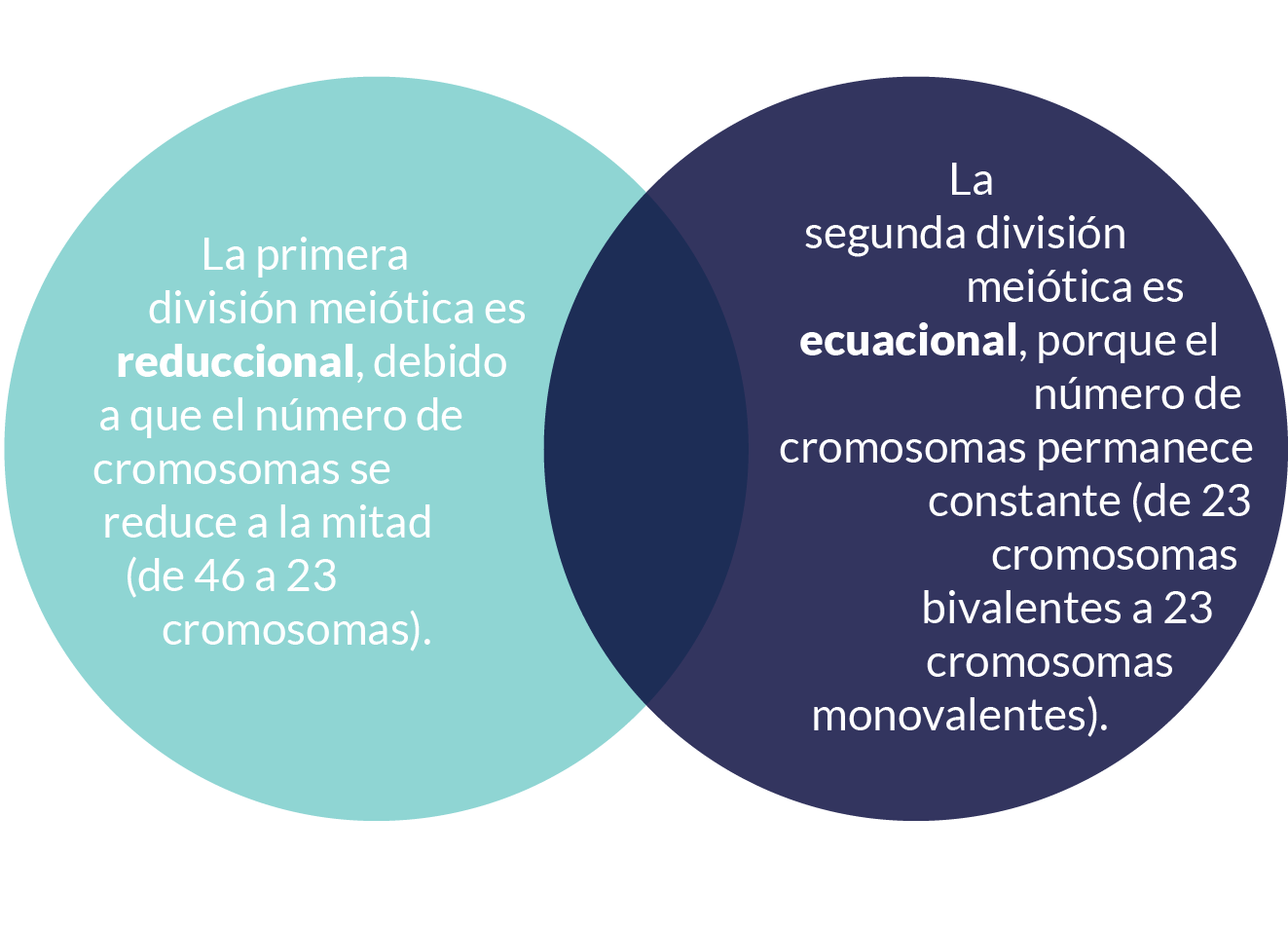
En la anafase, los cromosomas homólogos (duplicados) se segregan al azar, dividiendo así
el número de cromosomas de 46 a 23 (división reduccional). Durante esta fase las
cohesinas que se ubican alrededor del centrómero permanecen y mantienen juntas a las cromátidas
hermanas, a diferencia de lo que ocurre en la anafase mitótica, como se muestra en el esquema:
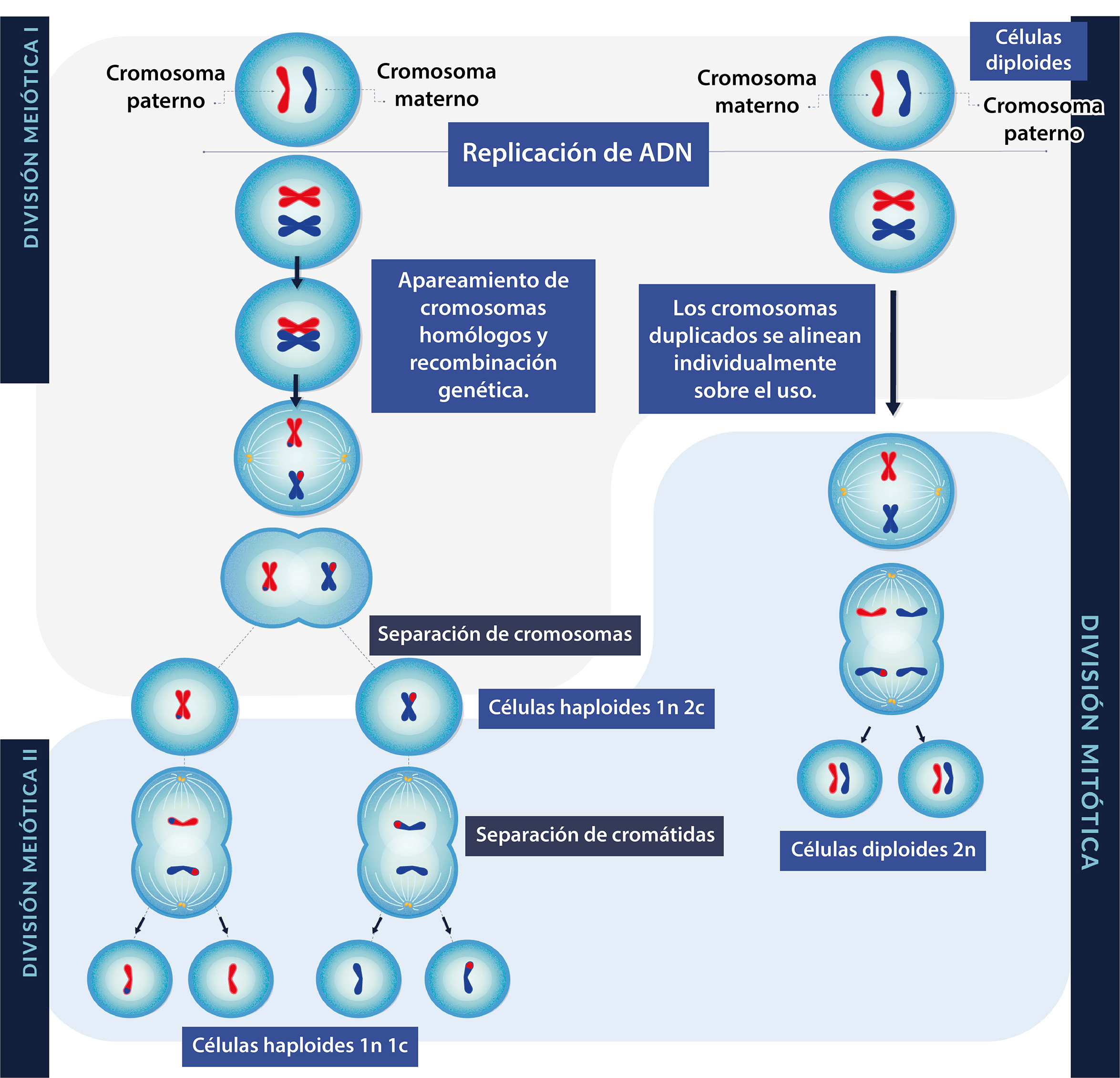
Comparación entre la división mitótica y las divisiones
meióticas
En la telofase, los cromosomas migran a los polos y se reconstituye la membrana nuclear. Finalmente, en la citocinesis la célula se divide en dos células hijas haploides, con cromosomas bivalentes (1n 2c) diferentes a la célula progenitora.

Como resultado de la primera división meiótica se obtienen células, cada una con 23 cromosomas (haploides) con fragmentos intercambiados y dos cromátidas hermanas (2c).
En la metafase II, los cromosomas bivalentes (1n 2c) se alinean en el ecuador para, posteriormente, separarse en la anafase II. Las cohesinas centroméricas se degradan permitiendo que las cromátidas hermanas se separen y migren hacia los polos. En la telofase II los cromosomas llegan a los polos y durante la citocinesis las células se separan, originándose cuatro células haploides monovalentes (1n1c), como se muestra en la figura.
El resultado de la segunda división meiótica son 4 células hijas, cada una con 23 cromosomas haploides con fragmentos intercambiados (1n) con una sola cromátida (1c)
Para conocer más detalles sobre las diferencias entre mitosis y meiosis, revisa la animación.
A continuación, se enlistan las principales diferencias entre ambos tipos de división
celular.
| Diferencias entre mitosis y meiosis | |
| Mitosis | Meiosis |
| Se produce en células somáticas del cuerpo. | Se produce en células sexuales. |
| Es un proceso conservativo. La información genética de las células hijas es igual a la de la célula progenitora. | Produce variabilidad en la información genética. Las células hijas son genéticamente diferentes entre sí y la célula progenitora. |
| Una división celular que origina dos células. | Dos divisiones celulares que originan cuatro células. |
| La interfase del ciclo celular se realiza una vez en cada división. | La interfase precede sólo a la primera división meiótica. No ocurre en la meiosis II. |
| La duplicación del DNA se realiza una vez por cada división celular. | La duplicación del DNA se realiza una vez por cada dos divisiones celulares. |
| La profase es corta; generalmente se realiza en unas horas. | La profase I comparativamente es más larga y puede llevar días. Está dividida en cinco subfases: leptoteno, zigoteno, paquiteno, diploteno y diacinesis. |
| No hay unión de los homólogos. | La sinapsis o unión de los homólogos se da durante la profase I. |
| No hay entrecruzamiento de cromosomas. No se forma complejo sinaptonémico. | Hay entrecruzamiento de cromosomas. Se forma complejo sinaptonémico. |
| No se forman quiasmas. | Se forman quiasmas. |
| La división de los centrómeros se realiza durante la anafase. | No hay división de centrómeros durante la anafase I; esta se realiza durante la anafase II. |
| Multiplicación, regeneración y reemplazo de células. | Es importante para la producción de gametos. |
Durante la meiosis I, los autosomas o cromosomas no sexuales se aparean con su homólogo, segregándose posteriormente y continuando hacia la segunda división meiótica. Pero ¿qué pasa con los cromosomas sexuales?
El apareamiento de estos cromosomas se realiza por la presencia de una pequeña región con secuencias idénticas presentes en ambos cromosomas, conocidas como regiones pseudoautosómicas (PARs: pseudoautosomal regions). La longitud de estas zonas es de aproximadamente 2.7 Mb para PAR1 y 0.33Mb para PAR2; en estas regiones, el cromosoma X y el cromosoma Y se aparean y se entrecruzan durante la profase de la meiosis I, como se observa en la imagen:
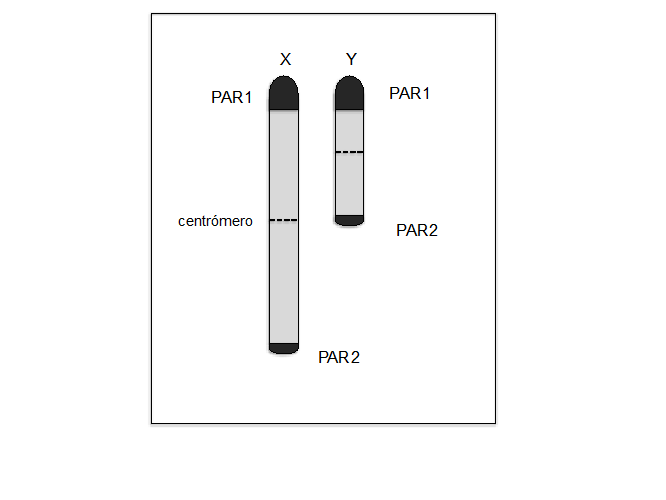
Estructura de los cromosomas sexuales en el hombre y la localización de
las regiones PAR1 y PAR2.
Se ha observado que la pérdida de PAR1 está relacionada con esterilidad masculina, lo que indica
que la existencia de PAR1 es necesaria para el apareamiento de las regiones homólogas entre los
cromosomas X-Y y su posterior separación en los gametos.
Durante la división mitótica y las divisiones meióticas pueden producirse errores en la segregación de los cromosomas, alterando su número y produciendo células con aneuploidías, es decir, células que presentan ganancia o pérdida de cromosomas, pero en número diferente a múltiplos del haploide (monosomía 2n-1; trisomía 2n+1). Estas alteraciones pueden identificarse con la realización de un cariotipo e incluyen la duplicación o delección de un cromosoma completo. Estas alteraciones pueden ser producidas por…
La no separación de los cromosomas, también llamada no disyunción, ocasiona desórdenes cromosómicos y ocurre cuando los cromosomas homólogos o las cromátidas hermanas no se separan durante la meiosis, debido generalmente a alteraciones en el uso mitótico. Estas anomalías cromosómicas pueden involucrar cromosomas somáticos o autosomas y cromosomas sexuales.
En humanos, las aneuploidías en los autosomas pueden ser fatales y causan abortos espontáneos durante el primer trimestre de embarazo; sin embargo, la ganancia de un cromosoma en algunos casos puede ser viable, aunque los productos con estas alteraciones manifiestan enfermedades congénitas severas.
Como puedes constatar, la no disyunción cromosómica puede producirse en cualquiera de las dos divisiones meióticas, originando células con diferente número de cromosomas. Revisa la animación para identificar los tipos de errores que pueden ocurrir durante la meiosis I o meiosis II.
En este esquema, puedes revisar las anomalías en la división meiótica l y ll.
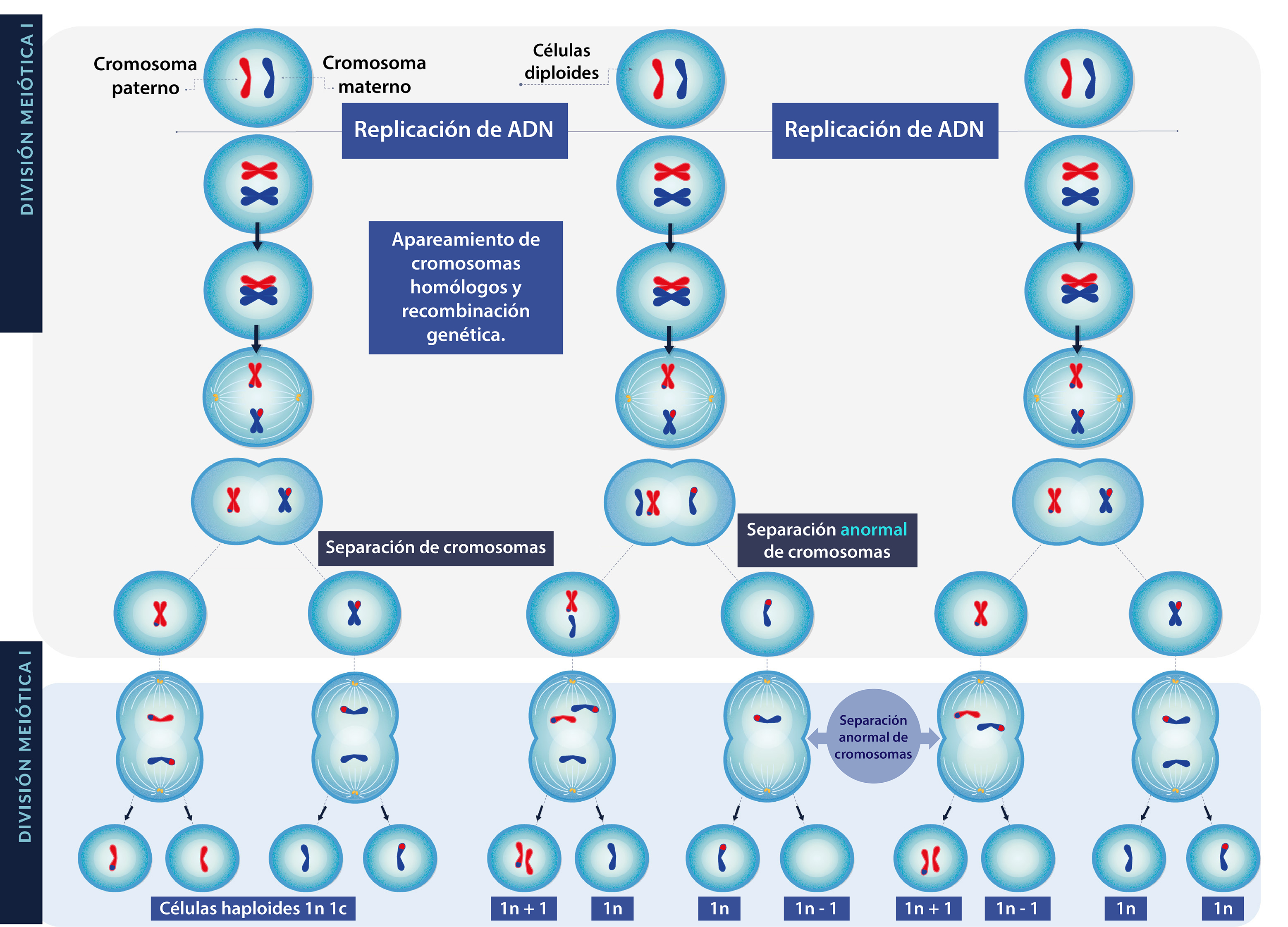
Se muestra la distribución de los cromosomas durante las dos
divisiones meióticas. Anomalías en la separación de los cromosomas (no disyunción)
pueden producirse tanto en la meiosis I como en la meiosis II (sólo se utilizó un par de
cromosomas para simplificar su comprensión).
Las aneuploidías son alteraciones cromosómicas producidas por una no disyunción durante la mitosis o meiosis produciendo células con un aumento (trisomías, tetrasomías) o disminución (monosomías) del número de cromosomas, diferente a múltiplos del haploide. Las características de las aneuploidías más comunes en el humano son las siguientes:
Las trisomías más comunes son el síndrome de Down (trisomía 21), el síndrome de Edwards (trisomía 18) y síndrome de Patau (trisomía 13). En el siguiente cuadro revisa sus características, su frecuencia, manifestaciones clínicas, esperanza de vida y citogenética.
Síndromes autosómicos
| Tipo | Aneuploidía autosómica producida por la presencia de un cromosoma 21 extra. |
| Frecuencia | 3.73 por cada 10 000 en México (2008-2011). Es la más común de las anomalías cromosómicas en infantes vivos. |
| Manifestaciones clínicas |
Fisura palpebral, pliegue epicántico, perfil facial plano/puente nasal
aplanado, oídos displásicos, implantación baja de orejas, braquicefalia,
manchas de Brushfield, boca abierta, lengua protruyente, cuello corto,
piel excesiva en la nuca, anomalías dentales, manos cortas y anchas,
pliegue palmar transversal, hiperflexibilidad de articulaciones,
hipotonía muscular, displasia de pelvis. Retraso mental, anomalías cardiovasculares: defectos en el septo atrioventricular, comunicación interventricular e interatrial, tetralogía de Fallot y persistencia del conducto arterioso. Anomalías gastrointestinales: tresia o estenosis duodenal, páncreas anular. El ano imperforado y la atresia y fístula esofágica son menos frecuentes. Las mujeres con síndrome de Down son fértiles, mientras que casi todos los hombres con este padecimiento son infértiles. |
| Esperanza de vida | En países desarrollados, la esperanza de vida es de alrededor de los 60 años. |
| Citogenética |
Trisomía libre y homogénea (92.5 %). Trisomía 21 por translocación. Robertsoniana (4.8 %). Mosaico (2.7 %). |
Para ampliar la información, consulta este enlace.
| Tipo | Aneuploidía autosómica producida por la presencia de un cromosoma 13 extra. |
| Frecuencia | 1/5000 nacimientos o 1/20 000 nacidos vivos. |
| Manifestaciones clínicas | Holoprosencefalia, agenesia de cuerpo calloso, microcefalia retraso mental severo, anoftalmia, ciclopia, coloboma de iris, polihidramnios, labio y paladar hendido, implantación baja de orejas, hemangiomas capilares, polidactilia, defectos en el corazón: dextrocardia, defectos septales, onfalocele, riñones poliquísticos. Anomalías en genitales: criptorquidia, hipospadias; en mujeres, útero bicorne. |
| Esperanza de vida | Cerca de la mitad de niños con esta anomalía muere en el primer mes de vida. El 10 % de infantes con este padecimiento sobrevive aproximadamente un año. |
| Citogenética |
Trisomía regular o libre (80 %). Mosaicos y translocación robertsoniana (20 %). 5 % de las translocaciones son heredadas de los padres. |
Para ampliar la información, consulta este enlace.
| Tipo | Aneuploidía autosómica producida por la presencia de un cromosoma 18 extra. |
| Frecuencia | Incidencia de 1/3000 a 1/10 000 nacimientos a nivel mundial. |
| Manifestaciones clínicas | Anomalías cardiovasculares, neurológicas, renales, gastrointestinales, respiratorias y esqueléticas. Esta trisomía está asociada a aproximadamente el 50 % de anomalías craneofaciales: occipucio prominente, implantación baja de orejas y micrognatia; anomalías en manos sindáctila, polidactilia y pies, las plantas de los pies están flexionadas dando apariencia de la parte de debajo de una mecedora; deformidades en el tórax: costillas anormales, escoliosis; hernia inguinal, pelvis pequeña; varones con criptorquidia; defectos en los septos ventriculares y auriculares, persistencia de conducto arterioso. Entre el 10-50 % de los casos muestra otras anomalías craneofaciales, estenosis pulmonar, coartación de la aorta, riñón en herradura, doble uréter, hidronefrosis y riñón poliquístico. El 50 % de los casos exhibe hipoplasia cerebelosa, agenesia de cuerpo calloso, hidrocefalia, mielomeningocele y malformación de Dandy-Waler. Todos los casos presentan trastornos mentales y psicomotores severos. |
| Esperanza de vida | Los problemas cardiacos, dificultades en la respiración y en la alimentación son factores que frecuentemente causan la muerte de estos bebes. Aproximadamente, el 50 % de los recién nacidos sobrevive cerca de una semana, mientras que el 90 % no sobrevive más de un año. |
| Citogenética |
Trisomía libre y homogénea (80 %). Mosaico (10 %). Traslocación (10 %). |
Para ampliar la información, consulta este enlace.
También pueden ocurrir aneuploidías de los cromosomas sexuales; la más común en las mujeres es el
síndrome de Turner (45 X0).
Síndromes de cromosomas sexuales
| Tipo | Única monosomía viable (X0), que afecta el desarrollo en mujeres. |
| Frecuencia | 1/2500 |
| Manifestaciones clínicas |
Estatura corta, pérdida temprana de la función ovárica
(inicialmente los ovarios se desarrollan, pero los ovocitos
generalmente mueren prematuramente y gran parte del tejido
ovárico degenera antes del nacimiento). La mayoría de pacientes
son infértiles y un pequeño porcentaje mantiene una función
ovárica normal hasta la edad adulta. Se presentan pliegues en el
cuello, implantación baja de cabello en la parte posterior del
cuello, linfedema en manos y pies, orejas de implantación baja y
prominentes, mandíbula pequeña, anomalías esqueléticas,
anomalías renales. Pubertad tardía. De un tercio a la mitad de pacientes con este síndrome presentan defectos cardiacos, como coartación de la aorta, anomalías en la válvula aórtica. La mayoría de niñas con síndrome de Turner tiene una inteligencia normal, aunque pueden presentarse retrasos en el desarrollo: dificultad con las habilidades de comunicación no verbal, relaciones espaciales, como conducir. |
| Esperanza de vida | Es un poco menor a la normal y mejora con el tratamiento de enfermedades crónicas asociadas, como la obesidad y la hipertensión. |
| Citogenética |
Cuerpo de Barr negativo. 60 % son 45 X0; de este grupo, el 80 % el cromosoma presente es el materno. 20 % se debe a anomalías estructurales: deleción de parte de los brazos cortos o largos del cromosoma X, isocromosoma y cromosoma en anillo. 20 % mosaicismo (45X/46XX; 45X/46XY; 45X/47XXX). |
Para ampliar la información, consulta este enlace.
| Tipo | Aneuploidía producida por la presencia de un cromosoma X adicional. |
| Frecuencia | 1/500 varones nacidos vivos. Su aparición se relaciona con edad materna. |
| Manifestaciones clínicas | La talla puede ser 2 a 5 cm mayor que en varones normales. Testículos poco desarrollados; en algunos casos, se presenta criptorquidia, hipospadias; baja producción de testosterona, ginecomastia, poco vello facial y corporal, infertilidad. Tienen mayor riesgo de presentar cáncer de mama. Personalidad callada y dócil; retraso en el habla. |
| Esperanza de vida | Igual que el resto de las personas. |
| Citogenética |
80 a 90 % 47 XXY. Mosaicismo 46XY/47XXY. |
Para ampliar la información, consulta este enlace.
En síntesis, la meiosis es un tipo de división celular con diferentes fases que produce variabilidad genética. Cuando ocurren errores durante este proceso, se producen síndromes cromosómicos de importancia médica que el profesional de la salud debe ser capaz de reconocer, diagnosticar y atender.
La mitosis y la meiosis son divisiones celulares que tienen diferencias importantes.
La comprensión de la división meiótica y sus fases son fundamentales para entender el origen de las anomalías cromosómicas de importancia médica, que pueden o no ser compatibles con la vida.
La meiosis es un tipo de división celular con determinadas fases que tiene un papel fundamental en la variabilidad genética, lo que nos permite entender el origen de anomalías cromosómicas de importancia médica.
Bibliografía
Alberts, B., Bray, D., Lewis, J., Raff, M., Roberts, K. & Watson, J. D. (1996). Biología
molecular de la célula (3.ª ed.). Barcelona: Omega.
Angel Rios, MD; Susan A. Furdon RNC, MS, NNP; Darius Adams, MD; and David A. Clark, MD.
(2004, december). Recognizing the clinical features of trysomy 13 syndrome. Focus on the
Physical. Susan A. Furdon, RNC, MS, NNP and David A. Clark MD, SERIES EDITORS. Advances
in Neonatal Care, 4(6), 332–343.
Argüello, O., Zagoriy, L., Mengoli, V., Rojas, J., Jonak, K., Oz, T., et al. (2017, January
9). Casein Kinase 1 coordinates cohesin cleavage, gametogénesis and exit from M phase in
Meiosis II. Developmental Cell, 40, 37-52. Elsevier, Inc.
Carlson, B. M. (2014). Embriología humana y biología del desarrollo (5.ª ed.).
Barcelona: Elseviers Saunders.
Flaquer, A., Rappold, G. A., Wienker, T. F. & Fisher, C. (2008). The human pseudoatosomal
regions: A review for genetic epidemiologists. European Journal of Human Genetics,
16, 771-779.
Grether, P. (1994). Alteraciones cromosómicas de los gonosomas. En J. Guízar. Genética
clínica. Diagnóstico y manejo de las enfermedades hereditarias (2.ª ed.) (pp.
227-238). Ciudad de México: El Manual Moderno.
Guízar, J. (1994). Genética clínica. Diagnóstico y manejo de las enfermedades
hereditarias (2.ª ed.) Ciudad de México: El Manual Moderno.
Kathryn K. Ostemaier P. (2018). Down syndrome: clinical features and diagnosis. Uptodate Jan
05.
Kuliev, A., Zlatopolsky, Z., Kirillova, I., Spivakova, J. & Cieslak, J. (2011). Meiosis
errors in over 20 000 oocytes studied in the practice of preimplantation aneuploidy testing.
Reprod. Biomed, 22, 2-8.
Menderes, Y. T., Muzeyyen, I. & Bulent, G. (2016). The cell fate: Senescence or quiescence.
Mol. Biol. Rep., 43, 1213-1220.
Méndez, L. A., Noche, G., Zaldívar, T., Maceiras, L. y Bravo, Y. (2016). Severos trastornos
neurológicos y malformaciones en una niña con monosomía del cromosoma 21. Revista Cubana
de Pediatría, 4(88). Ciudad de la Habana.
Ming Chen, Guang‐Perng Yeh, Jin‐Chung Shih, Bao‐Tyan Wang. (2004). Trisomy 13 mosaicism:
Study of serial cytogenetic changes in a case from early pregnancy to infancy.
Prenatal Diagnosis. (Short Communication)
Reichman, R., Alleva, B. & Smolikove, S. (2017). Prophase I: Prearing chromosomes for
segregation in the developing oocyte. In S. Arur (Ed.). Signaling-Mediated Control of
Cell Division, Results a Problems in Cell Differentiation 59. Switzerland: Springer
International Publishing.
Rios, A., Furdon, S. A., Adams, D., and Clark, D. (2004). Recognizing the clinical features
of trisomy 13 syndrome. Advances in Neonatal Care, 4(6), 332-343.
Sierra, R. M. C., Navarrete, H. E., Canún, S. S., Reyes, P. A. E. y Valdés, H. J. (2014).
Prevalencia del síndrome de Down en México utilizando los certificados de nacimiento vivo y
de muerte fetal durante el periodo 2008-2011. Bol. Med. Hosp. Infant. Méx., 71(5),
292-297.
Documentos electrónicos
Potapova, T. y Gorbsky, J. G. (2017). The Consequences of Chromosome Segregation Errors in
Mitosis an d Meiosis Biology. Consultado de
https://doi.org/10.3390/biology6010012
U. S. National Library of Medicine. (2018). Genetic home reference, your guido to understand
genetic conditions. Down syndrome. Consultado de
https://ghr.nlm.nih.gov/condition/down-syndrome
U. S. National Library of Medicine. (2018). Genetic home reference, your guido to understand
genetic conditions. Klinefelter syndrome. Consultado de
https://ghr.nlm.nih.gov/condition/klinefelter-syndrome
U. S. National Library of Medicine. (2018). Genetic home reference, your guido to understand
genetic conditions. Trisomy 13. Consultado de
https://ghr.nlm.nih.gov/condition/trisomy-13
U. S. National Library of Medicine. (2018). Genetic home reference, your guido to understand
genetic conditions. Trisomy 18. Consultado de
https://ghr.nlm.nih.gov/condition/trisomy-18
U. S. National Library of Medicine. (2018). Genetic home reference, your guido to understand
genetic conditions. Turner syndrome. Consultado de
https://ghr.nlm.nih.gov/condition/turner-syndrome
Cómo citar
Peralta, I., Valadez, L. y Nicolás, P. (2021). Meiosis. Unidades de Apoyo para el Aprendizaje. CUAED/Facultad de Medicina-UNAM. (Vínculo)